
【题目】某种自热食品的自热包上标注的成分是铝粉、生石灰、小苏打,自热包打开后加水即可大量放热。加水过程中发生的主要反应不可能是
A. 2Al+Ca(OH)2+2H2O=Ca(AlO2)2+3H2↑
B. Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O
C. 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
D. CaO+H2O=Ca(OH)2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( )
A. 现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3∶2∶1
B. 28 g CO和22.4 L CO2中含有的碳原子数一定相等
C. 标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D. a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科大发现了人工合成金刚石的新方法,化学原理为:Na+CO2![]() C(金刚石)+C(石墨)+Na2CO3(未配平),这种合成具有深远的意义。下列说法不正确的是
C(金刚石)+C(石墨)+Na2CO3(未配平),这种合成具有深远的意义。下列说法不正确的是
A. 该反应中,钠作还原剂,二氧化碳作氧化剂
B. 每生成1mol Na2CO3时,共转移4mol电子
C. 该反应中Na2CO3是氧化产物
D. 还原性Na大于C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbI2(亮黄色粉末)是生产新型敏化太阳能电池的敏化剂——甲胺铅碘的原料。合成PbI2的实验流程如图1:
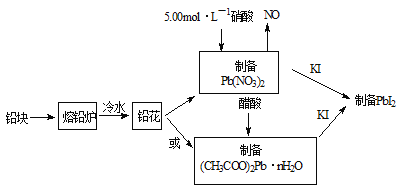

(1)将铅块制成铅花的目的是_____________。
(2)31.05g铅花用5.00mol·L-1的硝酸溶解,至少需消耗5.00 mol·L-1硝酸_______mL。
(3)取一定质量(CH3COO)2Pb·nH2O样品在N2气氛中加热,测得样品固体残留率)(![]() )随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水)。
)随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水)。
①(CH3COO)2Pb·nH2O中结晶水数目n=__________(填整数)。
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为___________(写分子式)。
(4)称取一定质量的PbI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s) + Pb2+(aq) = R2Pb(s) +2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中。加入2~3滴酚酞溶液,用0.002500mol·L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00mL。则室温时PbI2的Ksp为___________。
(5)探究浓度对磺化铅沉淀溶解平衡的影响。
该化学小组根据所提供试剂设计两个实验,来说明浓度对沉淀溶解平衡的影响。
提供试剂:NaI饱和溶液、NaCl饱和溶液、FeCl3饱和溶液、PbI2饱和溶液、PbI2悬浊液。
信息提示:Pb2+和Cl-能形成较稳定的PbCl42-络离子。
请填写下表的空白处:
实验内容 | 实验方法 | 实验现象及原因分析 |
①磺离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再滴入几滴NaI饱和溶液 | 现象:溶液中c(I-)增大,使Q大于了PbI2的Ksp |
②铅离子浓度减小对平衡的影响 | ________ | 现象:________ 原因:________ |
③________ | 在PbI2悬浊液中滴入几滴FeCl3饱和溶液 | 现象:黄色浑浊消失 ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。 乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体。由此他提出必须先除去杂质,再与溴水反应。请回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式: ___________、_______。
(2)甲同学设计的实验________(填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是________。
a.使溴水褪色的反应,未必是加成反应
b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙炔
d.使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体与溴水反应的化学方程式是__________,在验证过程中必须全部除去。
(4)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性。理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①Na;②NaCl溶液;③Na2O;④CO2溶液;⑤CO2;⑥NaOH;⑦Al2(SO4)3;⑧HCl;⑨BaSO4;⑩蔗糖
(1)属于电解质的是________________;属于非电解质的是________________;能导电的是_______。(用序号填写)
(2)0.5 mol SO2的质量是____ g。在标准状况下的体积为____L;含约________个氧原子。
(3)在Fe2O3+2Al![]() Al2O3+2Fe反应中,________元素的化合价升高,该元素的原子____(得到或失去)电子,_____________是氧化剂,______________是还原剂,________ 是还原产物,________是氧化产物。(填化学式)
Al2O3+2Fe反应中,________元素的化合价升高,该元素的原子____(得到或失去)电子,_____________是氧化剂,______________是还原剂,________ 是还原产物,________是氧化产物。(填化学式)
(4)请写出以下物质在水溶液中的电离方程式:
NaHCO3 _________________________; NaHSO4 __________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.将少量饱和氯化铁溶液滴入沸水中,继续煮沸,可制得Fe(OH)3胶体,反应的方程式为:FeCl3 + 3H2O ![]() Fe(OH)3(胶体) + 3HCl。
Fe(OH)3(胶体) + 3HCl。
①当溶液呈________时,停止加热,即制得Fe(OH)3胶体。
②氢氧化铁胶体与氢氧化铁沉淀的本质区别是____________________。
③下列叙述错误的是________。(单选)
A.雾属于胶体,能产生丁达尔效应
B.“PM2.5”悬浮在空气中形成胶体,危害人体健康 (“PM2.5”指大气中直径小于或等于2.5微米的细小颗粒物,也可称为可吸入肺颗粒物)
C.明矾、硫酸铁可以净水,净水原理和胶体有关
D.胶体在一定条件下能稳定存在,属于介稳体系
Ⅱ.现有下列纯净物:NaCl、SO3 、CH3COOH、石墨、HCl、蔗糖、乙醇、Fe、NaOH、H2SO4,其中
(1)固态能导电的是_________________________
(2)溶于水后形成的水溶液能导电的是___________________
(3)属于电解质的是_________________________________
(4)属于非电解质的是_________________________________
Ⅲ. 写出以下离子反应的离子方程式
(1)氢氧化钡溶液与硫酸铜混合:__________________________________________________
(2)氢氧化钠溶液中滴入稀硝酸:___________________________________________________
(3)稀盐酸除水垢中的碳酸钙:_____________________________________________________
(4)二氧化碳通入澄清石灰水中:___________________________________________________
(5)硝酸银溶液与稀盐酸反应:_____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼锡的第一步反应原理为2SnO2 + 3C![]() 2Sn + aM↑+ CO2↑,则下列说法中错误的是( )
2Sn + aM↑+ CO2↑,则下列说法中错误的是( )
A. 反应中SnO2被还原 B. a的值为3
C. 反应后有两种氧化产物 D. 每生成1 mol CO2转移电子8 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com