
 cC(№М)+dDөұ·ҙУҰҪшРРТ»¶ЁКұјдәуЈ¬ІвөГAјхЙЩБЛn molЈ¬BјхЙЩБЛn/2 molЈ¬CФцјУБЛ3n/2 molЈ¬DФцјУБЛn molЈ¬ҙЛКұҙпөҪ»ҜС§ЖҪәвЈә
cC(№М)+dDөұ·ҙУҰҪшРРТ»¶ЁКұјдәуЈ¬ІвөГAјхЙЩБЛn molЈ¬BјхЙЩБЛn/2 molЈ¬CФцјУБЛ3n/2 molЈ¬DФцјУБЛn molЈ¬ҙЛКұҙпөҪ»ҜС§ЖҪәвЈә
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
| AЈ®3.6ЎчH | BЈ®1.8ЎчH |
| CЈ®2ЎчH | DЈ®0.9ЎчH |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
 2NH3ТСҙпөҪЖҪәвЧҙМ¬өДКЗЈә
2NH3ТСҙпөҪЖҪәвЧҙМ¬өДКЗЈә| AЈ®И«Іҝ | BЈ®Ц»УРўЩўЫўЭ | CЈ®ўЪўЫўЭўЮ | DЈ®Ц»УРўЫўЭўЮ |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәМоҝХМв
ЕЁ¶И/molЎӨLЈӯ1
| NO | ЈБ | ЈВ | ||
| 0 | 0. 10 | 0 | 0 | ||
| 10 | 0.058 | 0.021 | 0.021 | ||
| 20 | 0.040 | 0.030 | 0.030 | ||
| 30 | 0.040 | 0.030 | 0.030 | ||
| 40 | 0.032 | 0. 034 | 0.017 | ||
| 50 | 0.032 | 0. 034 | 0.017 |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
 2SO3(g)ЎчHЈҪЎӘQ1 KJ/molЈ¬ПтГЬұХИЭЖчЦРНЁИл2mol SO2әН1mol O2Ј¬ҙпөҪЖҪәвКұ·ЕіцИИБҝQ2KJЈ¬Фт№ШПөКҪХэИ·өДКЗ
2SO3(g)ЎчHЈҪЎӘQ1 KJ/molЈ¬ПтГЬұХИЭЖчЦРНЁИл2mol SO2әН1mol O2Ј¬ҙпөҪЖҪәвКұ·ЕіцИИБҝQ2KJЈ¬Фт№ШПөКҪХэИ·өДКЗ| AЈ®Q1ЈҪQ2 | BЈ®Q1ЈјQ2 | CЈ®Q1ЈҫQ2 | DЈ®ОЮ·ЁұИҪП |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәМоҝХМв
 2(g)+3H2(g)
2(g)+3H2(g) 2NH3(g)Ј¬ИфФЪәгОВЎўәгС№МхјюПВПтЖҪәв
2NH3(g)Ј¬ИфФЪәгОВЎўәгС№МхјюПВПтЖҪәв Ме
Ме ПөЦРНЁИллІЖшЈ¬ЖҪәв ТЖ¶ҜЈЁМоЎ°ПтЧуЎұЎ°ПтУТЎұ»тЎ°І»ЎұЈ©Ј»К№УГҙЯ»ҜјБ ·ҙУҰөДЎчH ЈЁМоЎ°ФцҙуЎұЎ°јхРЎЎұ»тЎ°І»ёДұдЎұЈ©ЎЈ
ПөЦРНЁИллІЖшЈ¬ЖҪәв ТЖ¶ҜЈЁМоЎ°ПтЧуЎұЎ°ПтУТЎұ»тЎ°І»ЎұЈ©Ј»К№УГҙЯ»ҜјБ ·ҙУҰөДЎчH ЈЁМоЎ°ФцҙуЎұЎ°јхРЎЎұ»тЎ°І»ёДұдЎұЈ©ЎЈІйҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәМоҝХМв
 cCЈЁgЈ©ЈЁ
cCЈЁgЈ©ЈЁ HЈј0Ј©ФЪөИИЭМхјюПВҪшРРЎЈёДұдЖдЛы·ҙУҰМхјюЈ¬ФЪIЎўIIЎўIIIҪЧ¶ОМеПөЦРёчОпЦКЕЁ¶ИЛжКұјдұд»ҜөДЗъПЯИзПВНјЛщКҫЈә
HЈј0Ј©ФЪөИИЭМхјюПВҪшРРЎЈёДұдЖдЛы·ҙУҰМхјюЈ¬ФЪIЎўIIЎўIIIҪЧ¶ОМеПөЦРёчОпЦКЕЁ¶ИЛжКұјдұд»ҜөДЗъПЯИзПВНјЛщКҫЈә
 Јә
Јә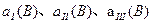 ЦРЧоРЎөДКЗ Ј¬ЖдЦөКЗ Ј»
ЦРЧоРЎөДКЗ Ј¬ЖдЦөКЗ Ј»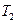 Ј©әНөЪIIIҪЧ¶О·ҙУҰЛЩ¶ИЈЁ
Ј©әНөЪIIIҪЧ¶О·ҙУҰЛЩ¶ИЈЁ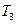 Ј©өДёЯөНЈә
Ј©өДёЯөНЈә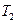
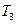 МоЎ°ЈҫЎўЈҪЎўЈјЎұЕР¶ПөДАнУЙКЗ ЎЈ
МоЎ°ЈҫЎўЈҪЎўЈјЎұЕР¶ПөДАнУЙКЗ ЎЈІйҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәјЖЛгМв
 ПВ·ҙУҰЈә2A (g)+ B (g)
ПВ·ҙУҰЈә2A (g)+ B (g) 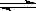 2C (g)ЎЈҫӯ60 sәу·ҙУҰҙпөҪЖҪәвЈ¬ҙЛКұИЭЖчДЪС№ЗҝОӘЖрКјКұС№ЗҝөД0.8ұ¶Ј¬КФјЖЛгЈә
2C (g)ЎЈҫӯ60 sәу·ҙУҰҙпөҪЖҪәвЈ¬ҙЛКұИЭЖчДЪС№ЗҝОӘЖрКјКұС№ЗҝөД0.8ұ¶Ј¬КФјЖЛгЈәІйҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
AЈ®SO2(g)+NO2(g) 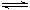 SO3(g)+NO(g)ЎчHЈј0 SO3(g)+NO(g)ЎчHЈј0 |
BЈ®C(s)+CO2(g) 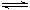 2CO(g)ЎчHЈҫ0 2CO(g)ЎчHЈҫ0 |
CЈ®4NH3(g)+5O2(g) 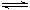 4NO(g)+6H2O(g)ЎчHЈј0 4NO(g)+6H2O(g)ЎчHЈј0 |
DЈ®H2S(g) 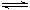 H2(g)+S(s)ЎчHЈҫ0 H2(g)+S(s)ЎчHЈҫ0 |
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com