
| A. | 0.12mol | B. | 0.2mol | C. | 0.4mol | D. | 0.8mol |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 条件 |
| A | K+、Na+、Cu2+、Cl- | 溶液呈无色 |
| B | Na+、Fe3+、NO3-、SO42- | 滴入酸性KMnO4溶液,溶液褪色 |
| C | Al3+、SO42-、Cl-、H+ | 加入氨水产生白色沉淀后沉淀溶解 |
| D | Na+、NO3-、I-、SO42- | 加入盐酸和淀粉溶液变蓝 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2可与HF反应,因而氢氟酸不能保存在玻璃瓶中 | |
| B. | SiO2可与水反应生成H2SiO3 | |
| C. | 向氯水中加CaCO3粉末,可提高溶液中HClO的浓度 | |
| D. | 向氯水中滴加蓝色石蕊试液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ |
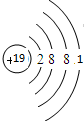 ,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示).
,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示). ,
,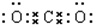 .
.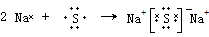 该化合物属于离子(填“共价”或“离子”)化合物.
该化合物属于离子(填“共价”或“离子”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
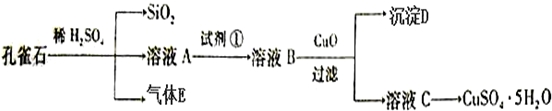
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| B. | 氢氧燃料电池正极消耗 22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | |
| C. | 欲配制1.00L 1.00mol.L-1的NaCl溶液,可将 58.5gNaCl溶于 1.00L水中 | |
| D. | 10LpH=13的NaOH溶液中含有的OH-离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 臭氧层中氧分解历程如图所示,下列说法正确的是( )
臭氧层中氧分解历程如图所示,下列说法正确的是( )| A. | 催化反应①②均为放热反应 | |
| B. | 催化剂不能改变该反应的反应热 | |
| C. | ClO是该反应的催化剂 | |
| D. | 在该反应过程中没有化学键的断裂与生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com