
【题目】在实验室中模拟“侯氏制碱法”,其实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,一段时间后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:分离C中所得的混合物,得到NaHCO3固体,进而生产出纯碱。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。
(1)下图所示装置的连接顺序是:a接_______,_______接______;b接_______(填接口序号)。
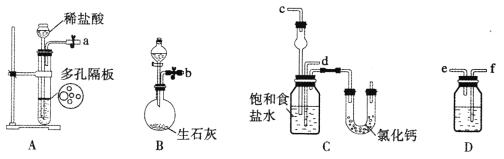
(2)A中常选用的固体反应物为_________;D中应选用的液体为____________。
(3)第二步中让___________装置先发生反应(填装置序号)。
(4)C中用球形干燥管而不用直导管,其作用是____________________;装有无水CaCl2的U形管的作用是__________________________。
(5)第三步分离出NaHCO3固体的操作是__________________________。
(6)第四步中所加固体粉末化学式为___________。所得的晶体中常含有少量的NaCl和NaHCO3(共约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4C1。简要写出操作和现象:____________________________________。
【答案】f e d c 石灰石 饱和碳酸氢钠溶液 B 防止倒吸 吸收多余的氨气 过滤 NaCl 取少量样品于试管中,用酒精灯加热,看到试管上端有白烟生成(或试管口有白色晶体),最后固体大部分消失、剩余极少量的固体,从而证明所得固体的成分大部分是氯化铵
【解析】
由“侯氏制碱法”的原理可知:实验时需先向饱和食盐水中通入足量的氨气,然后再通入二氧化碳气体,装置A为二氧化碳的发生装置,装置B为氨气的发生装置,装置C为反应装置,装置D为二氧化碳的净化装置,据此分析解答。
(1)装置A产生CO2,装置B产生NH3,装置D除去二氧化碳中的HCl,氨气通入C中应防止倒吸,则b接c, a接f、e接d,故答案为:f、e、d、c;
(2)A装置是制备二氧化碳气体的反应,一般采用盐酸与CaCO3反应来制取,所以A中固体反应物为石灰石,生成的二氧化碳气体中含有氯化氢,若不除去,会影响碳酸氢钠的产率,所以应用饱和碳酸氢钠溶液除去二氧化碳中的HCl,故答案为:石灰石、饱和碳酸氢钠溶液;
(3)因为氨气极易溶解于水,二氧化碳气体在水中溶解性较小,所以实验时,饱和食盐水中应先通入氨气,再通入二氧化碳气体,有利于气体的吸收,实验操作过程中,应让B装置先发生反应,故答案为:B;
(4)氨气极易溶于水,用直导管向饱和氯化钠溶液中通入氨气,容易发生倒吸,C中用球形干燥管,可以防止倒吸;多余的NH3能与CaCl2结合生成CaCl2·8NH3,所以装有无水CaCl2的U形管可吸收多余的NH3,故答案为:防止倒吸;吸收多余的氨气;
(5)第三步中得到的NaHCO3在溶液中以晶体的形式析出,分离出NaHCO3晶体采用的方法为过滤,故答案为:过滤;
(6)实验第四步可向溶液中加入NaCl粉末,有利于NH4Cl晶体的析出;若所得的晶体大部分为NH4Cl晶体,经过充分加热,NH4Cl会分解成气体,余下少量的氯化钠和碳酸钠等固体,故答案为:NaCl;取少量样品于试管中,用酒精灯加热,看到试管上端有白烟生成(或试管口有白色晶体),最后固体大部分消失、剩余极少量的固体,从而证明所得固体的成分大部分是氯化铵。


科目:高中化学 来源: 题型:
【题目】为探究某固体氧化物A(仅含两种元素)的组成和性质,设计并完成如下实验,。请回答:

(1)固体A的化学式______________。
(2)单质B在氯气中反应的现象_______________________________。
(3)写出C→D在溶液中发生氧化还原反应的离子方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镍[Nix(OH)y(CO3)z·nH2O]是一种绿色粉末,常用作催化剂和陶瓷着色剂,300 ℃以上时分解生成 3 种氧化物。为确定其组成,某同学在实验室进行了有关的探究。 请回答下列问题:
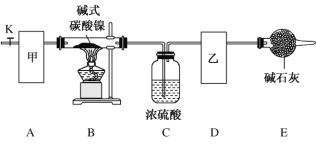
(1)装置 E 中仪器的名称是_____。
(2)甲、乙两装置可分别选取下列装置_____、_____(填字母,装置可重复选取)。

(3) 安装好实验仪器,检查装置气密性;称取一定量的碱式碳酸镍样品,放入硬质玻璃管内; 加热硬质玻璃管,当装置 C 中_____(填实验现象)时,停止加热;打开活塞 K,缓缓通入一段时间空气后,结束实验。
(4)装置 A 的作用是______________________________________________________________________。
(5)实验前后测得下表所示数据:
装置 B 中样品质量/g | 装置 C 质量/g | 装置 D 质量/g | |
实验前 | 3.77 | 132.00 | 41.00 |
实验后 | 2.25 | 133.08 | 41.44 |
已知碱式碳酸镍中 Ni 化合价为+2 价,则该碱式碳酸镍的化学式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存利用。利用NaOH溶液来“捕捉”CO2的过程如图所示(部分条件及物质未标出)。

下列说法错误的是
A. 能耗大是该方法的一大缺点
B. 整个过程中,有2种物质可以循环利用
C. “反应、分离”环节中,有复分解反应发生
D. “反应、分离”环节中,分离的基本操作是蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)某有机物(含C、H、O三种元素)分子球棍模型如图所示,下列有关叙述正确的是
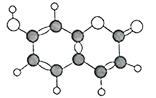
A. 分子式为C9H6O3
B. 不能使酸性KMnO4溶液褪色
C. 最多能与含1molNaOH的溶液反应
D. 能与碳酸氢钠溶液反应放出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体的叙述正确的是
A. 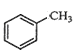 苯环上的一个氢原子被含1个氯原子取代,所得产物有5种
苯环上的一个氢原子被含1个氯原子取代,所得产物有5种
B. 丁烷(C4H10)的二氯取代物只能有4种
C. 菲的结构式为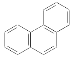 ,其一硝基取代物有10种
,其一硝基取代物有10种
D. 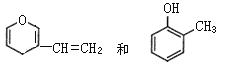 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是

A. 离子半径: X>Y>Z
B. WX3和水反应形成的化合物是离子化合物
C. 最高价氧化物对应的水化物酸性:R>W
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+,又含有Fe3+,将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4g硫单质,0.425mol FeCl2 和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A. 该盐酸的物质的量浓度为4.25mol·L-1
B. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
C. 成的H2S气体在标准状况下的体积为2.24L
D. 该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡(熔点232℃)与Cl2反应制备SnCl4,装置如图。

已知:①SnCl2、SnCl4有关物理性质:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | ﹣33 | 114 |
②SnCl4极易水解生成SnO2H2O。
回答下列问题:
(1)导管a的作用是____________________________________________________________,装置A中发生反应的离子方程式为________________________________________。
(2)当观察到装置F液面上方______________时才开始点燃D处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是____________________________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为____________________________________________________________。
(4)Cl2和锡的反应产物有SnCl4和SnCl2,为防止产品中带入过多的SnCl2,可采取的措施是____________________________________________________________。
(5)滴定分析产品中2价Sn(II)的含量:用分析天平称取5.000 g产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用0.1000 molL﹣1的碘标准溶液滴定至终点时消耗20.00 mL,则产品中Sn(II)的含量为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com