
【题目】(1)浓硫酸与木炭粉在加热条件下的化学方程式为________。
(2)已知酸性KMnO4溶液可以吸收SO2,试用下图所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左到右的方向)是:___→___→___→___。(填装置的编号)
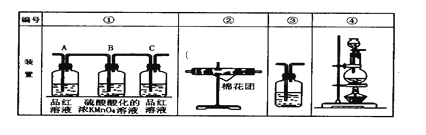
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是______,C瓶溶液的作用是______。
(4)装置②中所加的固体药品是______,装置③中所盛溶液是________。
【答案】2H2SO4(浓)+C![]() CO2↑+2H2O+2SO2↑ ④ ② ① ③ 验证产物气流中有SO2 确认产物气流中SO2已被B瓶溶液全部吸收 无水硫酸铜(或变色硅胶) 澄清石灰水
CO2↑+2H2O+2SO2↑ ④ ② ① ③ 验证产物气流中有SO2 确认产物气流中SO2已被B瓶溶液全部吸收 无水硫酸铜(或变色硅胶) 澄清石灰水
【解析】
根据实验原理及常见物质的的检验方法分析解答。
(1)浓硫酸具有强氧化性,可以将木炭氧化生成二氧化碳,本身被还原生成二氧化硫,化学方程式为:2H2SO4(浓)+C![]() CO2↑+2H2O+2SO2↑;
CO2↑+2H2O+2SO2↑;
(2)木炭与浓硫酸加热反应,生成CO2和SO2。CO2和SO2都跟Ca(OH)2反应,生成CaSO3和CaCO3,使澄清石灰水变浑浊,使反应产物无法验证。在SO2、CO2混合气体中,首先用品红溶液可检查SO2存在,然后将SO2氧化除去,再用澄清石灰水检验CO2的存在,故装置的连接顺序为:④②①③;
(3)根据实验目的及上述分析知,A瓶溶液的作用是 验证产物气流中有SO2 ;C瓶溶液的作用是 确认产物气流中SO2已被B瓶溶液全部吸收;
(4)装置②的目的是检验产物中的水,所以所加的固体药品是无水硫酸铜(或变色硅胶);装置③的目的是检验二氧化碳,所盛溶液是澄清石灰水。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】乙二酸(H2C2O4)俗称草酸,是二元弱酸。回答下列问题:
(1)在恒温、恒容密闭容器中发生反应:H2C2O4(s)![]() H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是____________(填标号)。
H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是____________(填标号)。
A.压强不再变化B.CO2(g)的体积分数保持不变
C.混合气体密度不再变化 D.混合气体平均摩尔质量保持不变
(2)草酸溶液中各离子浓度分数δ(X)随溶液pH变化的关系如图所示:

①当溶液中含碳粒子的主要存在形态为C2O42-时,溶液的酸碱性为____________(填标号)。
A.强酸性 B.弱酸性 C.中性 D.碱性
②25℃时,反应C2O42-+H2C2O4-![]() 2HC2O4-的平衡常数的对数值1gK=____________。
2HC2O4-的平衡常数的对数值1gK=____________。
(3)向10mL0.1mol·L-1H2C2O4溶液中逐滴加入0.1mol·L-1NaOH溶液,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,加入V(NaOH)____________10mL(填“>”“=”或“<”)。
(4)草酸晶体(H2C2O4·2H2O)为无色,某同学设计实验测定其纯度。实验过程如下:称取mg草酸晶体于试管中,加水完全溶解用cmol·L-1酸性KMnO4标准溶液进行滴定,则达到滴定终点时的现象是____________;该过程中发生反应的离子方程式为____________;滴定过程中消耗VmLKMnO4标准溶液,草酸晶体纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
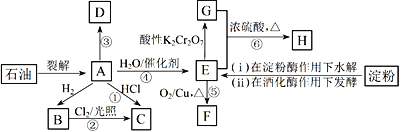
【题目】有机物A~H的转化关系如下图所示。其中A是植物生长调节剂,它的产量可以用来衡量一个国家的石油化工发展水平;D是一种合成高分子材料,此类物质如果大量使用易造成“白色污染”。
请回答下列问题:
(1)E的官能团名称为____________。反应③的反应类型__________________________。
(2)关于有机物A、B、C、D的下列说法,正确的是___________________(选填序号)。
a.B不能使溴水或酸性高锰酸钾溶液褪色,但A和D可以
b.B的同系物中,当碳原子数≥5时开始出现同分异构现象
c.等质量的A和D完全燃烧时消耗O2的量相等,生成CO2的量也相等
(3)写出下列反应的化学方程式:
反应④:_________________________________。反应⑤:_____________________________________。
(4)C是一种速效局部冷冻麻醉剂,可由反应①或②制备,请指出用哪一个反应制备较好:________,并说明理由:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C—C键可以绕键轴自由旋转,结构简式为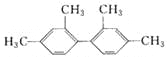 的烃,下列说法中正确的是
的烃,下列说法中正确的是
A. 分子中至少有9个碳原子处于同一平面上
B. 分子中至少有11个碳原子处于同一平面上
C. 分子中至少有16个碳原子处于同一平面上
D. 该烃属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:
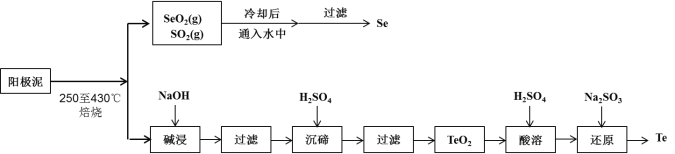
已知:①TeO2是两性氧化物。
②Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)Se在周期表中的位置为____________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有2 mol电子转移时,会生成______mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(3)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(4)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为_______________________________________。
(5)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是_______________________________________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),请通过计算说明_____________________________。(已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.5×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO==Na2CO3+N2H4·H2O+NaCl 据此,某学生设计了下列实验。
(制备NaClO溶液)
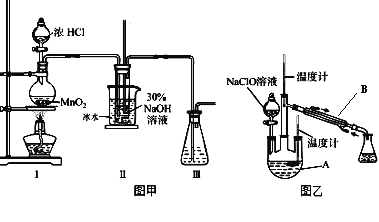
实验装置如图甲所示部分夹持装置已省略
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
(1)请写出肼的电子式_________________。
(2)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有___________。
(3)装置I中发生的化学反应方程式是 ____________________________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的是______________________________。
(制取水合肼)
实验装置如图乙所示。
(4)仪器B的名称为_________;反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4·H2O参与A中反应并产生大量氮气,请写出该反应的化学反应方程式_________________。
(5)充分反应后,加热蒸馏烧瓶A内的溶液即可得到水合肼的粗产品。若在蒸馏刚刚开始的时候忘记添加沸石,应该采取的操作是_____________________。
(测定肼的含量)
称取馏分0.2500g,加水配成20.00mL溶液,在一定条件下,以淀粉溶液做指示剂,用0.1500 mol·L-1的I2溶液滴定。
已知:N2H4·H2O+2I2==N2↑+4HI+H2O
滴定终点时的现象为_____________________________________。实验测得消耗I2溶液的平均值为20.00 mL,馏分中N2H4.H2O的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关糖类、脂肪和蛋白质的叙述正确的是( )
A.糖类都能表示为Cm(H2O)n
B.糖类和脂肪都是储能物质
C.脂肪由脂肪酸和甘油构成,所以脂肪是一种高分子化合物
D.糖类、脂肪和蛋白质都能氧化分解释放能量供给生物利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中
(1)互为同分异构体的是________,
(2)互为同素异形体的是________,
(3)互为同位素的是________,
(4)属于同一物质的是________。
①C(CH3)4和C4H10
②![]() 和
和![]()
③35Cl和37Cl
④![]() H2O和
H2O和![]() H2O
H2O
⑤石墨和金刚石
⑥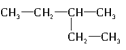 和
和![]()
⑦(CH3)2CHCH(CH3)2 和(CH3)2CH(CH2)2CH3
⑧H2 D2 T2
⑨CH2=CH-CH2CH3和CH3-CH=CH-CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com