
| A. | X、Y、Z三种元素可以组成一种盐 | |
| B. | Y和Z可以组成一种Y和Z的质量比为7:8的化合物 | |
| C. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒都有2种 | |
| D. | X和Z可以组成原子个数比分别为1:1和2:1常温下为液态的两种化合物 |
分析 X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,则X是H元素;
Z原子的最外层电子数是次外层的3倍,最外层电子数不超过8个,则Z次外层为K层,为O元素;
Y和Z可以形成两种以上常温下呈气态的化合物,且原子序数Y大于H而小于O元素,所以Y为N元素,
A.X、Y、Z三种元素可以组成一种盐硝酸铵;
B.N和O可以组成一种N和O的质量比为7:8的化合物,两种元素的物质的量之比=$\frac{7}{14}:$$\frac{8}{16}$=1:1,物质的量之比等于原子个数之比,形成的化合物分子中N、O原子个数之比为1:1;
C.由H、N、O三种元素中的任意两种组成的具有10电子的微粒都有3种;
D.H和O可以组成原子个数比分别为1:1和2:1常温下为液态的两种化合物分别是双氧水和水.
解答 解:X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,则X是H元素;
Z原子的最外层电子数是次外层的3倍,最外层电子数不超过8个,则Z次外层为K层,为O元素;
Y和Z可以形成两种以上常温下呈气态的化合物,且原子序数Y大于H而小于O元素,所以Y为N元素,
A.X、Y、Z三种元素可以组成一种盐,为硝酸铵,故A正确;
B.N和O可以组成一种N和O的质量比为7:8的化合物,两种元素的物质的量之比=$\frac{7}{14}:$$\frac{8}{16}$=1:1,物质的量之比等于原子个数之比,形成的化合物分子中N、O原子个数之比为1:1,该化合物为NO,故B正确;
C.由H、N、O三种元素中的任意两种组成的具有10电子的微粒都有3种,分别为NH3、NH2-、NH4+、H2O、H3O+、OH-,故C错误;
D.H和O可以组成原子个数比分别为1:1和2:1常温下为液态的两种化合物分别是双氧水和水,分子式分别为H2O2、H2O,故D正确;
故选C.
点评 本题考查原子结构和元素性质,侧重考查元素周期表结构、原子结构及微粒结构是解本题关键,同时考查学生发散思维能力,易错选项是C,知道常见10电子微粒,题目难度中等.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
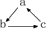 关系相互转化的是(“→”表示一步完成)( )
关系相互转化的是(“→”表示一步完成)( )| 选项 | A | B | C | D |
| a | SiO2 | NaOH | HNO3 | Cu |
| b | Na2SiO3 | Na2CO3 | NO | CuSO4 |
| c | H2SiO3 | NaHCO3 | NO2 | Cu(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| C. | Fe (NO3)2与HI的反应:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| D. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
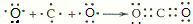 ;用电子式表示C、D两元素形成化学键的过程
;用电子式表示C、D两元素形成化学键的过程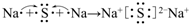 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑤ | B. | 只有①③④ | C. | ①②③④⑤ | D. | 只有①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
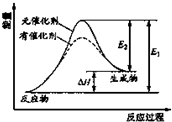 某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )
某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )| A. | 该反应为放热反应 | |
| B. | 催化解能改变反应的焓变 | |
| C. | 催化解能降低反应所需活化能,增大活化分子百分数 | |
| D. | 逆反应的活化能大于正反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素X、Y、Z、W、E、Q在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21.回答下列问题
短周期元素X、Y、Z、W、E、Q在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21.回答下列问题| X | Y | Z | W |
| E | Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | E(4s)>E(3p)>E(3d) | B. | E(3s)>E(3p)>E(3d) | C. | E(6s)>E(4f)>E(5d) | D. | E(5s)>E(4p)>E(3d) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | NH3•H2O | C. | CuO | D. | BaCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com