
25℃时,部分弱酸的电离平衡常数如表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.8×10﹣5 | 4.9×10﹣10 | K1=4.3×10﹣7 K2=5.6×10﹣11 |
下列有关说法正确的是( )
A. 等物质的量浓度溶液的pH关系为pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B. a mol•L﹣1HCN溶液与b mol•L﹣1NaOH溶液等体积混合后,所得溶液中:c(Na+)>c(CN﹣),则a一定小于b
C. 往冰醋酸中逐滴加水,溶液的导电性逐渐增大
D. 将0.2 mol•L﹣1 KHCO3溶液与0.1 mol•L﹣1 KOH溶液等体积混合:c(K+)+c(H+)=c(OH﹣)+c(HCO3-)+2c(CO32-)
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源:2016-2017学年广东省汕头市高一上学期期末考试化学试卷(解析版) 题型:选择题
已知2MOyx-+5S2-+16H+=2M2++5S↓+8H2O,则MOyx-中的M的化合价为
A. +3 B. +4 C. +6 D. +7
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省石家庄市高一上学期期末考试化学试卷(解析版) 题型:选择题
下面是有关厨房中的常见操作或常见现象,其中不属于氧化还原反应的是
A. 烧菜用过的铁锅,经放置常出现红棕色斑迹
B. 用气灶燃烧沼气(主要成分为甲烷)为炒菜提供热量
C. 牛奶久置变质腐败
D. 氧化铜固体加入稀盐酸中,完全溶解
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
已知气体的密度与它的摩尔质量成正比。一只气球若放在空气(空气的平均摩尔质量是29 g·mol-1)中可静止不动,那么在相同条件下该气球放在下列气体中会下沉的是
A. O2 B. Cl2 C. CO2 D. CH4
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三上学期期末联考化学试卷(解析版) 题型:简答题
钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,钨在自然界主要以钨(VI) 酸盐的形式存在。有开采价值的钨矿石之一白钨矿的主要成分是CaWO4 ,含有二氧化硅、氧化铁等杂质,工业冶炼钨流程如下:
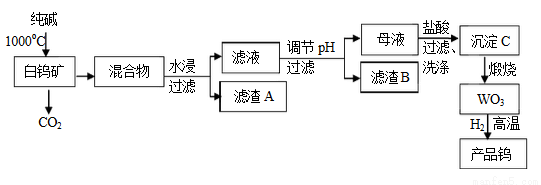
已知:
① 钨酸酸性很弱,难溶于水
② 完全沉淀离子的pH值:SiO32--为8,WO42--为5
③碳和金属钨在高温下会反应生成碳化钨
(1)74W在周期表的位置是第________周期。
(2)CaWO4与纯碱发生的化学反应方程式是_________________。
(3)滤渣B的主要成分是(写化学式)_____________。
调节pH可选用的试剂是:__________(填写字母序号)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.碳酸钠溶液
(4)母液中加入盐酸的离子方程式为____________________。
检验沉淀C是否洗涤干净的操作是:_______________________
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而须用氢气作还原剂的原因是:______________________________
将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知温度为T时Ksp(CaWO4) =1×10-10,Ksp[Ca(OH)2]= 4×10-7,当溶液中WO42-恰好沉淀完全(离子浓度等于10-5mol/L)时,溶液中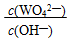 等于_________________
等于_________________
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三上学期期末联考化学试卷(解析版) 题型:选择题
下列有关实验装置进行的相应实验,能达到实验目的的是( )

A. 用图1所示装置除去Cl2中含有的少量HCl
B. 用图2所示装置蒸干FeCl3饱和溶液制备FeCl3固体
C. 用图3所示装置制取少量纯净的CO2气体
D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三上学期期末联考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A. 手机外壳上贴的碳纤维外膜是一种新型的有机高分子材料
B. 绿色化学的核心是对环境产生的污染进行治理
C. 氯化铵、二氧化硫溶于水都能导电,所以它们都属于电解质
D. 云、烟、雾等均能产生丁达尔现象
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:选择题
常温下,已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01mol·L-1的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性。则对( )
A. 高碘酸和碘酸都是强酸 B. 高碘酸和碘酸都是弱酸
C. 高碘酸是弱酸、碘酸是强酸 D. 高碘酸是强酸、碘酸是弱酸
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期期末考试理综化学试卷(解析版) 题型:简答题
H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
I.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为________________________。
II.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为____________。
(3)己知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27,该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通人H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=_________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) H2S(g)+CO(g) △H=+7 kJ·mol-1;
H2S(g)+CO(g) △H=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
(4)己知:断裂1 mol分子中的化学键所需吸收的能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/ kJ·mol-1 | 1319 | 442 | x | 678 | -930 | 1606 |
表中x=___________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
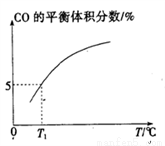
①随着温度升高,CO的平衡体积分数____________(填“增大”或“减小”),原因为_______________。
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_________;反应i的平衡常数为____________(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com