
【题目】X元素最高氧化物对应的水化物为H2XO3,则它对应的气态氢化物为
A. HXB. H2XC. XH3D. XH4
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A. 氨水中加酸,NH4+的浓度增大
B. 合成氨工业中不断从反应混合物中液化分离出氨气
C. 实验室中常用排饱和食盐水的方法收集Cl2
D. 合成氨控制在500 ℃左右的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验以探究元素性质的递变规律,实验装置如图所示.
(1)实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律.
已知A装置的烧瓶里装有大理石,分液漏斗里装有稀HNO3 , B装置中装有饱和碳酸氢钠溶液,装置C中装有Na2SiO3溶液,试回答:
①A中反应的离子方程式为 , C中可观察到的现象是 .
②B装置的作用是 .
③根据实验现象推知,碳酸、硝酸、硅酸的酸性强弱顺序是 , 由此得出碳、硅、氮三种元素非金属性的强弱顺序是 .
(2)实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱.
④写出B装置中发生反应的离子方程式: .
⑤C装置的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中:


(1)能与NaOH溶液反应的是_________________。(填序号,下同)
(2)能与溴水发生反应的是___________________。
(3)能发生消去反应的是_____________________。
(4)遇FeCl3溶液显紫色的是__________________。
(5)能与Na2CO3溶液反应的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,将A逐滴加入B中:
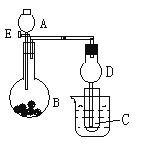
(1)若B为Na2CO3粉末,C为C6H5ONa溶液,实验中观察到小试管内溶液由澄清变浑浊,则试管C中化学反应的化学方程式: 。然后往烧杯中加入沸水,可观察到试管C中的现象: 。
(2)若B是生石灰,观察到C溶液中先形成沉淀,然后沉淀溶解。当沉淀完全溶解,恰好变澄清时,关闭E然后往小试管中加入少量乙醛溶液,再往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是 (填名称),C是 (填化学式),与乙醛的混合后,该溶液中反应的化学方程式: 。实验结束时用 清洗银镜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等质量的下列物质分别溶于足量的水配制成等体积的溶液,其中C(SO42-)最大的是( )
A. Na2SO4 B. MgSO4 C. Fe2(SO4)3 D. Al2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上消除氮氧化物的污染,可用如下反应:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法不正确的是
A. 10 min内,T1时v(CH4)T2时小 B. 温度:T1<T2
C. ΔH:a < 0 D. 平衡常数:K(T1)<K(T2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,取浓度均为0.1mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是

A. 曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B. 曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C. 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
D. 曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对温室气体二氧化碳的研究一直是科技界关注的重点。
I.在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一,相关反应如下:
主反应:CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H1①
副反应:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2kJ/mol
已知H2和CH4的燃烧热分别为-285.5kJ·mol-1和-890.0kJ·mol-1
H2O(l)=H2O(g) △H=+44 kJ·mol-1
(1)△H1=______kJ·mo l-1。
(2)有利于提高CH4平衡产率的反应条件是(至少写两条)_________。工业上提高甲烷反应选择性的关键因素是_____________。
(3)T℃时,若在体积恒为2L的密闭容器中同时发生上述反应,将物质的量之和为5mol的H2和CO2以不同的投料比进行反应,结果如图所示。若a、b表示反应物的转化率,则表示H2转化率的是______,c、d分别表示CH4(g)和CO(g)的体积分数,由图可知![]() =______时,甲烷产率最高。若该条件下CO的产率趋于0,则T℃时①的平衡常数K=________。
=______时,甲烷产率最高。若该条件下CO的产率趋于0,则T℃时①的平衡常数K=________。

II.溶于海水的CO295%以HCO3-形式存在。在海洋中,通过如下左图钙化作用实现碳自净。

(4)写出写出钙化作用的离子方程式____________。
(5)电解完成后,a室的pH值______(“变大”、“变小”或“几乎不变”);其间b室发生反应的离子方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com