
(15分)X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X原子基态时最外层电子数是其内层电子数的2倍 |
|
Y |
Y原子基态时2p原子轨道上有3个未成对的电子 |
|
Z |
Z的基态原子最外层电子排布式为:nsnnpn+2 |
|
W |
W的原子序数为29 |
(1)基态W原子的价电子排布式是_________________。
(2)X、Y、Z三种元素第一电离能从大到小的顺序是____________。(填化学式)
(3)Y的氢化物分子的空间构型是_______________;该氢化物分子中Y原子轨道的杂化类型是___________。
(4)X的气态氢化物 和Y的气态氢化物中沸点高的是 ,(填化学式)其主要原因是 。
(5)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。
(1)3d104s1 (2分) (2)N> O> C (2分) (3)三角锥形 sp3 杂化 (每空2分)
(4) NH3 (1分) NH3分子存在氢键(2分) (5)PbBaO3 共12个(每空2分)
【解析】
试题分析:X原子基态时最外层电子数是其内层电子数的2倍,所以X是C。Y原子基态时2p原子轨道上有3个未成对的电子,因此Y是N。Z的基态原子最外层电子排布式为:nsnnpn+2,所以n=2,则Z是O。W的原子序数为29,因此W是Cu。
(1)根据构造原理可知,基态W原子的价电子排布式是3d104s1。
(2)非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,所以氮元素的第一电离能大于氧元素的,即X、Y、Z三种元素第一电离能从大到小的顺序是N> O> C。
(3)Y的氢化物是NH3,其中中心原子氮原子含有(5-3×1)÷2=1对孤对电子,所以氨气是三角锥形结构,其中氮元原子是sp3杂化。
(4)由于NH3分子间存在氢键,所以氨气的沸点高于甲烷的沸点。
(5)Pb4+处于立方晶胞顶点,所以Pb原子的个数是8×1/8=1;Ba2+处于晶胞中心,则Ba原子个数是1;O2-处于晶胞棱边中心,因此氧原子个数是12×1/4=3,所以该化合物的化学式是PbBaO3。根据该晶胞的结构可知,每个Ba2+与12个O2-配位。
考点:考查核外电子的排布、电离能大小比较、分子结构的判断、分子沸点大小比较以及晶体化学式的判断等
点评:该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用所学的知识解决具体化学问题的能力。本题基础性较强,属于中等难度的试题。


科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X原子的L层电子数是K层电子数的2倍 |
| Y | Y原子的最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的原子核 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |


查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
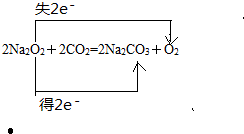
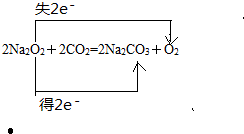
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 相关信息 |
| X | X的一种核素质量数为14,中子数为7 |
| Y | Y的过氧化物是一种淡黄色固体,可用作供氧剂 |
| Z | Z的基态原子M层电子数比L层少2个 |
| W | W的基态原子的价电子排布式为3d104sl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| Z | W |
| A、X | B、Y | C、Z | D、W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com