
下列关于离子键的特征的叙述中,正确的是
A.一种离子对带异性电荷离子的吸引作用与其所处的方向无关,故离子键无方向性
B.因为离子键无方向性,故阴、阳离子的排列是没有规律的、随意的
C.因为氯化钠的化学式是NaCl,故每个Na+周围吸引一个Cl-
D.因为离子键无饱和性,故一种离子周围可以吸引任意多个带异性电荷的离子
科目:高中化学 来源: 题型:
现有常温下的六份溶液:
①0.01 mol·L-1CH3COOH溶液;
②0.01 mol·L-1HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol·L-1CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01 mol·L-1HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是 (填序号,下同),水的电离程度相同的是 ;
(2)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:② ③(填“>”“<”或“=”);
(3)将六份溶液同等稀释10倍后,溶液的pH:
① ②,③ ④,⑤ ⑥(填“>”“<”或“=”);
(4)将①、④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈 (填序号)。
A.酸性 B.碱性 C.中性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列评价及离子方程式书写正确的是( )
| 选项 | 离子组 | 评价 |
| A | H+、Fe2+、 | 不能大量共存于同一溶液中,因为发生了氧化还原反应4Fe2++2 |
| B | Na+、 | 不能大量共存于同一溶液中,因为有沉淀生成2Al3++3 |
| C |
| 能大量共存于同一溶液中 |
| D |
| 不能大量共存于同一溶液中,因为发生如下反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去)。
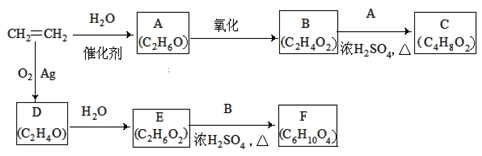
请回答下列问题:
(1)A的化学名称是 。
(2)B和A反应生成C的化学方程式为 ,该反应的类型为 。
(3)D为环状化合物,其结构简式为 。
(4)F的结构简式为 。
(5)D的同分异构体的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
A.元素X的常见化合价是+1 B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对分子的性质的解释中,不正确的是
A.水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致
B.乳酸(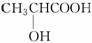 )有一对手性异构体,因为其分子中含有一个手性碳原子
)有一对手性异构体,因为其分子中含有一个手性碳原子
C.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
D.酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数比HClO的多
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.L2+与R2-的核外电子数相等
B.M与T形成的化合物既能与酸反应又能与强碱反应
C.氢化物的稳定性为H2T<H2R
D.单质与浓度相等的稀盐酸反应的速率为Q>L
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇可通过将煤气化过程中生成的CO和H2在一定条件下,发生如下反应制得:CO(g)+2H2(g) CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
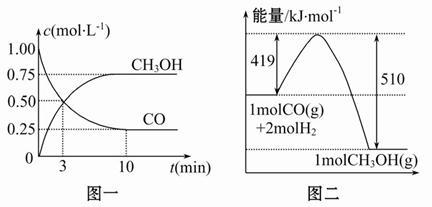
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=______,CO的转化率为________。
(2)该反应的平衡常数表达式为______________,温度升高,平衡常数______(填“增大”“减小”或“不变”)。
(3)若在一体积可变的密闭容器中充入1 mol CO、2 mol H2和1 mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则加入各物质后该反应向_____(填“正”“逆”)反应方向移动,理由是______________________
__________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com