
下列物质按纯净物、混合物、电解质和非电解质顺序排列的是
A.盐酸、空气、醋酸、干冰 B.蛋白质、油脂、苛性钾、石灰石
C.冰醋酸、福尔马林、硫酸钠、乙醇 D.胆矾、漂白粉、氯化钾、硫酸钡
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
X、Y、Z、W四种物质的转化关系如图所示。下列组合中不符合该关系的是( )
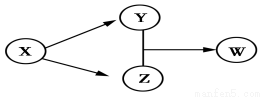
| A | B | C | D |
X | HCl | Na2O2 | Na2CO3 | SO2 |
Y | FeCl2 | NaOH | CO2 | Na2SO3 |
Z | Cl2 | Na2CO3 | CaCO3 | H2SO4 |
W | FeCl3 | NaHCO3 | Ca(HCO3)2 | NaHSO3 |
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
用等体积的0.1mol/L的BaCl2 溶液,可使相同体积的Fe2 (SO4 )3 、 Na2 SO4 、 KAl(SO4)2 三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为
A. 3:2:3 B. 3:1:2 C. 2:6:3 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源:2015届江西省南昌市高三8月月考化学试卷(解析版) 题型:选择题
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是

A.a点的溶液呈中性
B.b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH— == Al(OH)3↓+2BaSO4↓
C.c点加入Ba(OH)2溶液的体积为200 mL
D.c点溶液呈碱性
查看答案和解析>>
科目:高中化学 来源:2015届江西省南昌市高三8月月考化学试卷(解析版) 题型:选择题
下列各组离子在相应的条件下一定能大量共存的是
A.在碱性溶液中:HCO3-、K+、C1-、Na+
B.与铝粉反应放出氢气的无色溶液中:NO3-、K+、Na+、SO42-
C.在c(H+)/c(OH-)==1×1013的溶液中:NH4+、Br-、C1-、K+
D.通有SO2的溶液中: Ca2+、C1-、NO3-、A13+
查看答案和解析>>
科目:高中化学 来源:2015届江西省南昌市三校高三上第一次联考化学试卷(解析版) 题型:填空题
(9分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO42- HCO3- NO3- OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。根据上述实验填空:
(1)写出B、D的化学式:B ,D 。
(2)将含l mol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,该化合物化学式为________________。
(3)C常用作净水剂,用离子方程式表示其净水原理 。
(4)在A溶液中加入过量澄清石灰水,其离子方程式为 .
(5)向20mL 2mol/L C溶液中加入60mL E溶液,充分反应后得到0.78g沉淀,则E
溶液的物质的量浓度可能是 moI/L。
查看答案和解析>>
科目:高中化学 来源:2015届江西省南昌市三校高三上第一次联考化学试卷(解析版) 题型:选择题
关于某无色溶液中所含离子的鉴别,下列判断正确的是
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
C.加入Ba(NO3)2,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次考试化学试卷(解析版) 题型:填空题
(7分)金属钒(V)在材料科学上有重要作用,被称为“合金的维生素”。以下是测定矿石中钒的含量的两个反应:
(1)用稀硫酸溶解五氧化二钒,得到(VO2)2SO4溶液。写出该反应的化学方程式
____________________________________________________________;
该反应______(选填“是”或“不是”)氧化还原反应。
(2)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,完成下列离子方程式,方框内填数字,短线上填写物质的化学式或离子符号。
VO2+ + H2C2O4 + ______ → VO2+ + CO2 + ______
(3)当收集到标准状况下气体112毫升时,电子转移的数目为
(4)甲同学提出:上述反应能否用盐酸酸化?乙同学认为:要回答这个问题还得知道
A.VO2+ 和HCl氧化性相对强弱 B.VO2+ 和Cl2氧化性相对强弱 C.上述均不正确.
查看答案和解析>>
科目:高中化学 来源:2015届江西五校高三第一次联考化学试卷(解析版) 题型:填空题
(16分)常温下,将某可溶性一元碱XOH和HCl溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | XOH物质的量浓度(mol·L-1) | HCl物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH<7 |
丁 | 0.1 | 0.1 | pH=5 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明XOH是强碱还是弱碱_________________________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________ (选填“是”或“否”)。混合液中离子浓度c(Cl-)与 c(X+)的大小关系是________________________。
(3)丙组实验结果分析,XOH是________碱(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Cl-)-c(X+)=________mol·L-1 c(H+)-c(XOH)=________mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com