
 苯是一种石油化工基本原料,也是最简单的芳烃.苯分子中的一个氢原子分别被甲基、羟基、氨基取代生成的化合物是甲苯、苯酚和苯胺.
苯是一种石油化工基本原料,也是最简单的芳烃.苯分子中的一个氢原子分别被甲基、羟基、氨基取代生成的化合物是甲苯、苯酚和苯胺.分析 (1)氧是8号元素,根据核外电子排布规律书写基态氧原子的电子排布式;碳是6号元素,外围有4个电子,据此书写基态碳原子外围电子排布;
(2)A.氮的基态原子的核外电子排布为1s22s22p3,氧元素基态原子的核外电子排布为1s22s22p4;
B.氮原子核外最外层是半满结构,是一种稳定结构,所以元素第一电离能:N>O;
C.元素的非金属性越强,元素的电负性越大,所以电负性:H<C<N<O;
D.苯胺晶体溶于苯不公与范德华力有关,还与氢键有关;
(3)不同原子之间形成的供价键是极性键,双键或参键中含有σ键和π键,据此判断;
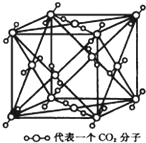
(4)根据均摊法,晶体中含有苯分子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,根据$ρ=\frac{m}{V}$计算苯的密度.
解答 解:(1)氧是8号元素,根据核外电子排布规律可知基态氧原子的电子排布式为1s22s22p4,碳是6号元素,外围有4个电子,基态碳原子外围电子排布为2s22p2,
故答案为:1s22s22p4;2s22p2;
(2)A.氮的基态原子的核外电子排布为1s22s22p3,氧元素基态原子的核外电子排布为1s22s22p4,故A正确;
B.氮原子核外最外层是半满结构,是一种稳定结构,所以元素第一电离能:N>O,故B错误;
C.元素的非金属性越强,元素的电负性越大,所以电负性:H<C<N<O,故C正确;
D.苯胺晶体溶于苯不公与范德华力有关,还与氢键有关,故D错误,
故选BD;
(3)不同原子之间形成的供价键是极性键,同种原子之间形成非极性键,所以CH4、CO2只有极性键,故选BF,双键或参键中含有σ键和π键,所以同时存在σ键和π键的分子是N2、C6H6、C6H5OH、CO2、C6H5NH3Cl,故选ACDF,
故答案为:BF;ACDF;
(4)根据均摊法,晶体中含有苯分子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,根据$ρ=\frac{m}{V}$可知,晶胞的密度为$\frac{\frac{4×78}{{N}_{A}}}{{a}^{3}}$g•cm-3=$\frac{4×78}{{N}_{A}{a}^{3}}$g•cm-3,
故答案为:4;$\frac{4×78}{{N}_{A}{a}^{3}}$.
点评 本题主要考查了外围电子排布、化学键类型的判断、晶胞的计算等,题目难度中等,答题时注意极性共价键和非极性共价键的区别,注重基础知识的考查.


科目:高中化学 来源: 题型:选择题
| A. | ①②④⑦ | B. | ②③⑥⑦ | C. | ④⑤⑥⑦ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要检验己烯中是否混有少量甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液 | |
| B. | 配制浓硫酸和浓硝酸的混酸时,将浓硝酸沿壁缓缓倒入到浓硫酸中 | |
| C. | 制硝基苯时,将盛有混合液的试管直接在酒精灯火焰上加热 | |
| D. | 除去乙酸乙酯中少量的乙酸,可以加氢氧化钠溶液后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
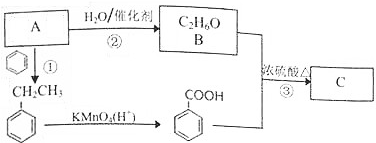
 +CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$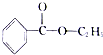 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到冷浓硝酸中:2Al+6H+=2Al3++3H2↑ | |
| B. | 铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 用小苏打治疗胃酸过多:H++HCO3-=H2O+CO2↑ | |
| D. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲的球棍模型 | 乙的结构式 | 丙的球棍模型 | 丁的比例模型 |
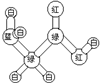 | 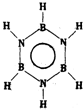 | 丙的分子式为C13H10O3 | 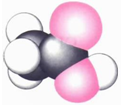 |
| A. | 甲可代表氨基酸 | B. | 乙的二氯代物有3种 | ||
| C. | 丙的结构简式为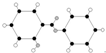 | D. | 丁可代表乙酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com