(1)ag铁粉放入含bmolHNO3的浓硝酸中,加热充分反应后,再加入稀硫酸,铁粉恰好完全溶解,经测定溶液中只含Fe3+(一种金属离子)和SO42-(一种酸根离子).
①写出反应开始时溶液中发生反应的化学方程式______ Fe(NO3)2+2NO2↑+2H2O
【答案】
分析:(1)开始是浓硝酸和铁加热发生的反应,加入硫酸后,硝酸根离子在酸溶液中形成稀硝酸,可以氧化金属铁和亚铁离子,依据离子方程式产物和电荷守恒,原子守恒写出离子方程式;
(2)①依据接触法制硫酸的工业流程和设备反应分析判断;二氧化硫生成三氧化硫的反应是可逆反应,氧气是通入的空气,氮气不反应;
②依据三氧化硫吸收的方法是利用浓硫酸吸收,防止形成酸雾,阻止吸收分析判断;
③依据接触法制硫酸的反应原理结合化学方程式进行计算;
解答:解:①反应开始时溶液中发生反应,铁在加热条件下和浓硝酸发生的反应,再加入稀硫酸,铁粉恰好完全溶解,说明铁过量,反应的化学方程式为:Fe+4HNO
3(浓)

Fe(NO
3)
2+2NO
2↑+2H
2O;
故答案为:Fe+4HNO
3(浓)
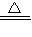
Fe(NO
3)
2+2NO
2↑+2H
2O;
②铁和浓硝酸反应生成二价铁离子,再加入稀硫酸,铁粉恰好完全溶解,经测定溶液中只含Fe
3+(一种金属离子)和SO
42-(一种酸根离子);发生的反应是铁和稀硝酸反应,亚铁离子被硝酸氧化为三价铁离子,反应的两种方程式为:Fe+4H
++NO
3-═Fe
3++NO↑+2 H
2O; 3Fe
2++4H
++NO
3-═3Fe
3++NO↑+2 H
2O;
故答案为:Fe+4H
++NO
3-═Fe
3++NO↑+2 H
2O; 3Fe
2++4H
++NO
3-═3Fe
3++NO↑+2 H
2O;
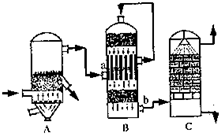
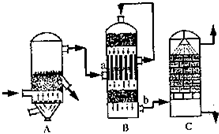
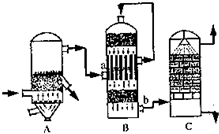
(2)①B设备是二氧化硫催化氧化为三氧化硫的设备在接触室进行反应,二氧化硫催化油器生成三氧化硫的反应是可逆反应,化学平衡状态下存在的物质有,SO
3、SO
2、O
2、N
2;
故答案为:接触室;SO
3、SO
2、O
2、N
2 ②设备C中用98.3%的H
2SO
4来吸收SO
2的原因是,用水吸收易形成酸雾阻止三氧化硫的吸收;
故答案为:为了提高SO
3的吸收效率,防止形成酸雾;
③燃烧1t含硫质量分数为48%的黄铁矿石,在理论上能生产98%H
2SO
4制硫酸的反应为:4FeS
2+11O
2=2Fe
2O
3+4SO
2;2SO
2+O
2=2SO
3;SO
3+H
2O=SO
3;
依据硫元素守恒得到:设生成98%H
2SO
4xt
S~~~~H
2SO
4 32 98
1t×48% 98%×xt
得到x=1.5t
故答案为:1.5;
点评:本题考查了铁及其化合物性质的分析应用,硝酸的强氧化性,产物的判断,接触法制硫酸的工业流程,设备作用,题目难度中等.

 Fe(NO3)2+2NO2↑+2H2O;
Fe(NO3)2+2NO2↑+2H2O;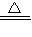 Fe(NO3)2+2NO2↑+2H2O;
Fe(NO3)2+2NO2↑+2H2O;