
| A. | 0.1mol丙烯中含有共价键的数目为0.6NA | |
| B. | 0.1mo Cl2全部溶于水后转移电子的数目为0.1NA | |
| C. | 标准状况下,2.24LSO3中含有氧原子的数目为0.3NA | |
| D. | 9.2g由乙醇和二甲醚(CH3OCH3)组成的混合物中含有氧原子的数目为0.2NA |
分析 A.1分子丙烯中含有3个碳碳键和6个碳氢键;
B.氯气和水的反应为可逆反应;
C.气体摩尔体积使用对象为气体;
D.乙醇与二甲醚互为同分异构体,1分子乙醇和二甲醚都只含有1个氧原子;
解答 解:A.0.1mol丙烯中含有0.3mol碳碳键和0.6mol碳氢键,总共含有0.9mol共价键,所含的共价键数目为0.9NA,故A错误;
B.氯气和水的反应为歧化反应且为可逆反应,故0.1mol氯气不能和水反应完全,故转移的电子数小于0.1NA个,故B错误;
C.标准状况下SO3不是气体,不能使用气体摩尔体积,故C错误;
D.乙醇与二甲醚互为同分异构体,9.2g由乙醇和二甲醚(CH3OCH3)物质的量为$\frac{9.2g}{46g/mol}$=0.2mol,含有氧原子的数目为0.2NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的分析判断,主要是物质结构分析,气体摩尔体积条件应用,掌握公式的使用和物质的结构是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 事 实 | 解 释 |
| A | 金属镁燃烧不能用CO2来扑灭 | 镁与CO2要反应 |
| B | 一滴水中大约有1.67×1021个水分子 | 水分子很小 |
| C | 敞口容器中的酒精逐渐减少 | 分子是不断运动的 |
| D | 遭到核辐射后要多吃含“碘”食物 | 碘元素能屏蔽核辐射 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C4H10 | D. | C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
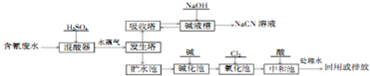
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:推断题
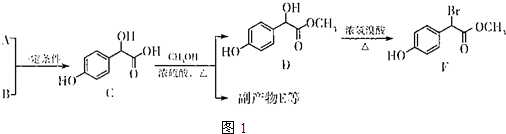
 .
. 中①、②、③3个-OH的酸性有强到弱的顺序是:③>①>②.
中①、②、③3个-OH的酸性有强到弱的顺序是:③>①>②.
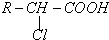

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃枓电池、铅蓄电池、硅太阳能电池都利用了原电池原理 | |
| B. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| C. | 为防止重金属等污染土壤和水体,废电池应回收综合利用 | |
| D. | 用可降解的“玉米塑料”制作一次性饭盒,能减少“白色污染” |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
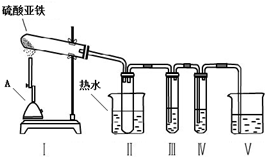
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入 KSCN溶液(或B). | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加 2滴黄色K3[Fe(CN)6]溶液. | 产生蓝色沉淀 | 固体中含有FeO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com