
分析 (1)根据反应方程式分析,每消耗2molSO2,生成1molS2(g);
(2)恒容条件下,已知反应为2SO2(g)+CH4(g)?CO2(g)+2H2O(g)+S2(g)+Q(Q>0),反应为放热反应,随着反应进行,气体分子数增加,气体压强增大,据此判断;
(3)反应为氧化还原反应,SO2做氧化剂,CH4做还原剂,根据电子转移分析,氧化产物是CO2,SO2的主要性质除氧化性、漂白性外还有还原性和酸性氧化物性;
(4)反应混合物中有两种极性分子,极性分子是指分子中正负电荷中心不重合的分子,固态硫的分子式可能是S8,和S2均为单质,含有相同元素;
(5)烟道气中的NO2也能与CH4反应并生成无害气体,可判断为CO2和H2O和N2,据此写出反应的方程式,根据方程式计算.
解答 解:(1)根据反应方程式分析,每消耗2molSO2,生成1molS2(g),则SO2的反应速率是S2生成速率的2倍,
故答案为:2;
(2)恒容条件下,已知反应为2SO2(g)+CH4(g)?CO2(g)+2H2O(g)+S2(g)+Q(Q>0),反应为放热反应,随着反应进行,气体分子数增加,气体压强增大,
a.混合气体中水蒸气含量不再变化,能说明化学反应是否达到平衡,故a不选;
b.混合气体密度为$ρ=\frac{{m}_{气}}{{V}_{容器}}$,反应均为气体的反应,气体总质量反应前后质量守恒,保持不变,恒容容器体积不发生改变,则整个反应达到化学平衡前后,混合气体的密度都不变,不能根据密度说明化学反应是否达到平衡,故b选;
c.随着反应进行,气体分子数增加,气体压强增大,当容器内压强不再变化时,可以说明化学反应是否达到平衡,故c不选;
d.混合物平均相对分子质量为$\overline{{M}_{r}}$=$\frac{{m}_{气}}{{n}_{气}}$,反应前后质量守恒,混合气体总质量不变,随着反应进行,混合气体的物质的量发生改变,当混合物平均相对分子质量不再变化时,可以说明反应是否达到平衡,故d选;
反应为放热反应,达到平衡后升高体系温度,化学反应正反趋势增大,则则平衡常数K增大,
故答案为:b;增大;
(3)反应为氧化还原反应,SO2做氧化剂,CH4做还原剂,标出上述反应中电子转移的方向和数目为 ,
,
氧化产物是CO2,SO2的主要性质除氧化性、漂白性外还有还原性和酸性氧化物的性质,
故答案为: ;CO2;还原;酸性氧化物;
;CO2;还原;酸性氧化物;
(4)反应混合物中有两种极性分子,极性分子是指分子中正负电荷中心不重合的分子,则分别是SO2和H2O,固态硫的分子式可能是S8,它与S2互为同素异形体,
故答案为:SO2;H2O;同素异形体;
(5)烟道气中的NO2也能与CH4反应并生成无害气体,可判断为CO2和H2O和N2,反应的化学方程式为:2NO2+CH4═CO2+N2+2H2O,完全转化3.0molNO2气体时,根据反应方程式计算,则需要甲烷的物质的量为1.5mol,
故答案为:1.5.
点评 本题考查化学平衡的相关知识,化学平衡的判断,氧化还原反应中电子的转移,极性分子的知识,SO2的性质,根据反应方程式的简单计算,为综合题型,题目难度不大,是基础题.


科目:高中化学 来源: 题型:选择题
| A. | 在该反应中维生素C作催化剂 | |
| B. | 因为河虾中含有砷元素,所以不能食用 | |
| C. | 砒霜是砷的氧化物,由上述可推知砒霜中含有的砷是+3价 | |
| D. | 上述反应中维生素C作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉在潮湿空气中易变质 | |
| B. | 光导纤维的主要成分是硅单质 | |
| C. | 贮氢合金的发现和应用,开辟了解决氢气贮存、运输难题的新途径 | |
| D. | 钢铁在潮湿空气里比在干燥空气里更易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、NH4+、Cl-、SO42- | B. | Na+、H+、Cl-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、SO42- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 洁净煤技术(CCT)是煤的高效清洁利用的技术.煤中的硫主要以黄铁矿(FeS2)为主,其次为磁硫铁矿(Fe7S8)、闪锌矿(ZnS)、方铅矿(PbS)等.回答下列问题:
洁净煤技术(CCT)是煤的高效清洁利用的技术.煤中的硫主要以黄铁矿(FeS2)为主,其次为磁硫铁矿(Fe7S8)、闪锌矿(ZnS)、方铅矿(PbS)等.回答下列问题: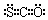 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10种 | B. | 8种 | C. | 6种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有② | B. | ①和③ | C. | ②和③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的溶液时,洗净的容量瓶要放进烘箱中烘干,以防溶液被稀释 | |
| B. | 由CuSO4溶液制备CuSO4•5H2O的操作:将溶液蒸发至剩有少量液体时,停止加热 | |
| C. | 酸碱滴定实验中,用待测溶液润洗锥形瓶,以减少实验误差 | |
| D. | 中和热的测定实验中,要用环形玻璃搅拌棒搅拌,使反应更充分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ | B. | Al3+ | C. | Fe3+ | D. | Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com