
|
| 0.05×106 |
| 9.5 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| n(CO2) mol | 2 | 3 | 4 | 6 |
| n(沉淀) mol | 1 | 2 | 4 | 3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
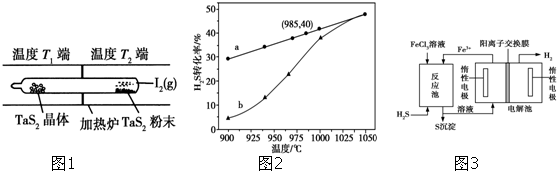
查看答案和解析>>
科目:高中化学 来源: 题型:
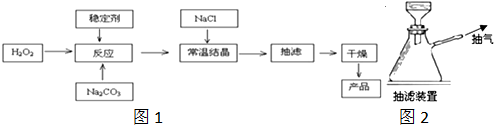
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸式滴定管用蒸馏水洗净后,必须用已知浓度的盐酸润洗 |
| B、锥形瓶用蒸馏水洗净后,用NaOH溶液润洗后再加入待测液 |
| C、滴定时,必须逐出滴定管下口的气泡 |
| D、读数时,视线与滴定管内液体的凹液面最低处保持水平 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用容量瓶配制溶液时,定容时仰视刻度线,所配溶液浓度偏小 |
| B、用润湿的pH试纸测溶液的pH,所测pH不一定有误差 |
| C、测定中和反应的反应热时,将碱分多次倒入酸中,所测△H偏小 |
| D、酸碱中和滴定时,滴定前盛装标准液的滴定管内有气泡,终点读数时气泡消失,所测结果偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液态氯化氢、固态氯化钠不导电,所以HCl、NaCl不是电解质 |
| B、NH3、CO2水溶液均能导电,所以NH3、CO2均是电解质 |
| C、蔗糖、酒精在水溶液中或熔化时不导电,所以它们不是电解质 |
| D、铜、石墨均导电,所以它们是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、NaF的电子式[:
| ||||
| B、乙醇的结构简式C2H6O | ||||
C、铝的原子结构示意图 | ||||
| D、硫酸的电离方程式H2SO4═H22++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序 号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com