
| A. | c2=2c1 | B. | c2>2c1 | C. | c2<2c1 | D. | 无法确定 |
分析 利用c=$\frac{1000ρw}{M}$计算硫酸的物质的量浓度,且硫酸溶液的浓度越大其密度也越大,以此来解答.
解答 解:设将溶质质量分数为a%的硫酸溶液密度为ρ1,
则c1=$\frac{1000{ρ}_{1}a%}{98}$mol/L=$\frac{10a{ρ}_{1}}{98}$mol/L,
设将溶质质量分数为2a%的硫酸溶液密度为ρ2,
则c2=$\frac{1000{ρ}_{2}2a%}{98}$mol/L=$\frac{20a{ρ}_{2}}{98}$mol/L,
所以c1:c2=$\frac{10a{ρ}_{1}}{98}$mol/L:$\frac{20a{ρ}_{2}}{98}$mol/L=ρ1:2ρ2,
即c2=$\frac{2{ρ}_{2}}{{ρ}_{1}}$c1,硫酸溶液的浓度越大密度也越大,所以ρ2>ρ1,所以$\frac{2{ρ}_{2}}{{ρ}_{1}}$>2,即c2>2c1,
故选B.
点评 本题考查物质的量浓度与质量分数的相互换算,为高频考点,把握浓度与质量分数的关系及硫酸溶液的浓度越大密度也越大为解答的关键,侧重分析与计算能力的考查,注意氨水、酒精浓度越大密度越小,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 | |
| B. | 可逆反应达到平衡后,正、逆反应速率均为0 | |
| C. | 2 mol SO2 与1 mol O2混合一定能生成2 mol SO3 | |
| D. | 使用催化剂不一定能加大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏和煤的干馏都属于物理变化 | |
| B. | 苯、四氯化碳和乙醇可用水加以鉴别 | |
| C. | 蔗糖和淀粉在稀硫酸的催化作用下最终水解产物相同 | |
| D. | 乙烯和苯分子中都含有碳碳双键,都能与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
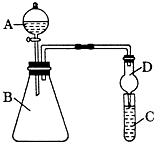 某同学为探究元素和化合物性质的递变规律,设计了如下系列实验.
某同学为探究元素和化合物性质的递变规律,设计了如下系列实验.| A中加入物质 | B中加入物质 | C中加入物质 | 实验结论 |
| 稀硫酸或盐酸 | 碳酸钠(或碳酸盐) | 硅酸钠溶液 | 酸性:盐酸>碳酸>硅酸 |
| 氢氧化钠溶液(强碱溶液) | 氯化铵(或铵盐) | 氯化铜溶液(难溶碱的可溶性盐溶液) | 碱性:氢氧化钠>一水合氨>氢氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净物一定由分子组成 | |
| B. | 由同种分子构成的物质一定是纯净物 | |
| C. | 混合物一定是由两种以上元素构成的 | |
| D. | 含有氧元素的化合物都是氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片在溶解,铁片上有无色气体生成 | |
| B. | 电流表指针没有偏转 | |
| C. | 电子从铁片流出经过导线流向铜片 | |
| D. | 电池总反应为Cu+2H+═H2+Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com