
| A. | 氯水能导电,所以氯水属于电解质 | |
| B. | Al(OH)3既能溶于盐酸又能溶于NaOH溶液,属于两性氢氧化物 | |
| C. | 能电离产生H+的化合物一定是酸 | |
| D. | 饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液 |
分析 A、混合物既不是电解质,也不是非电解质;
B、根据两性氢氧化物的定义分析;
C、酸式盐也能电离出氢离子;
D、如果某物质的溶解度很小,其饱和溶液也是稀溶液.
解答 解:A、氯水是混合物,既不是电解质,也不是非电解质,故A错误;
B、Al(OH)3既能溶于盐酸又能溶于NaOH溶液,属于两性氢氧化物,故B正确;
C、酸式盐也能电离出氢离子,故C错误;
D、如果某物质的溶解度很小,其饱和溶液也是稀溶液;如果某物质的溶解度很大,其饱和溶液可能是浓溶液,故D错误.
故选B.
点评 本题重点考查了电解质概念的辨析,解题时紧抓住电解质必须是化合物,以及导电是在水溶液或熔化状态下为条件,共价化合物在熔融时不导电,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O═NaN3+NaOH+NH3,3NaNH2+NaNO3═NaN3+3NaOH+NH3↑.
叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O═NaN3+NaOH+NH3,3NaNH2+NaNO3═NaN3+3NaOH+NH3↑. .
. HN3+OH-;.
HN3+OH-;.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每摩尔甲基中含10NA个电子 | |
| B. | 标准状况下2.24 L乙醇与足量Na反应生成H2分子数0.05NA | |
| C. | 14 g乙烯含有H原子数为2NA | |
| D. | 78 g苯中含有的碳碳双键的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
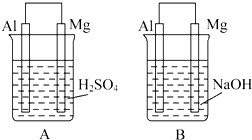 有A、B两位学生均想利用原电池反应验证金属的活动性顺序,并探究产物的有关性质.分别设计如图所示的原电池,请完成以下问题:
有A、B两位学生均想利用原电池反应验证金属的活动性顺序,并探究产物的有关性质.分别设计如图所示的原电池,请完成以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3.
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com