
分析 n(C2H2)=$\frac{13g}{26g/mol}$=0.5mol,则0.5molC2H2(g)完全燃烧生成CO2和H2O(l)时,放出659kJ的热量,可知1molC2H2(g)完全燃烧生成CO2和H2O(l)时,放出热量为659kJ×2=1318kJ,结合物质的状态及焓变书写热化学方程式.
解答 解:n(C2H2)=$\frac{13g}{26g/mol}$=0.5mol,则0.5molC2H2(g)完全燃烧生成CO2和H2O(l)时,放出659kJ的热量,可知1molC2H2(g)完全燃烧生成CO2和H2O(l)时,放出热量为659kJ×2=1318kJ,该反应的热化学方程式为C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g+)H2O(l)△H=-1318kJ/mol,
故答案为:C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g+)H2O(l)△H=-1318kJ/mol.
点评 本题考查热化学方程式的书写,为高频考点,把握物质的量与热量的关系、放热反应与焓变的关系等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ①②④⑤⑧ | C. | ①②③④⑨ | D. | ②④⑦⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
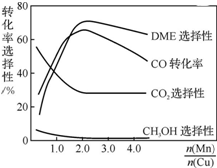 采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME).观察上右图回答问题:催化剂中$\frac{n(Mn)}{n(Cu)}$约为2.0时最有利于二甲醚的合成.
采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME).观察上右图回答问题:催化剂中$\frac{n(Mn)}{n(Cu)}$约为2.0时最有利于二甲醚的合成.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
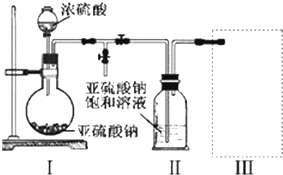
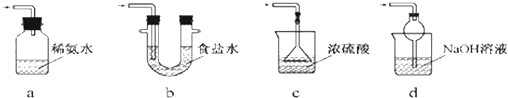

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 | 阳极 | 阴极 | 甲溶液 | 物质乙 |
| A | Ag | Cu | AgNO3溶液 | AgNO3固体 |
| B | C | Cu | CuSO4溶液 | Cu(OH)2 |
| C | Pt | Pt | NaOH溶液 | NaOH固体 |
| D | C | Fe | NaCl溶液 | HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t/(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (I)由短周期元素构成的A~E五种物质中都含有同一种元素,B为单质.
(I)由短周期元素构成的A~E五种物质中都含有同一种元素,B为单质.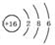 ,A既能与强酸又能与强碱反应,且都能产生气体,请画出A的电子式为
,A既能与强酸又能与强碱反应,且都能产生气体,请画出A的电子式为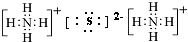 或
或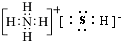 .
.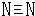
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温时水呈液态是因为水分子间可以形成氢键 | |
| B. | NH3易溶于水的原因之一是它与水分子间能形成氢键因为能形成氢键 | |
| C. | H2O比H2S稳定是因为水分子间可以形成氢键,而H2S不能 | |
| D. | 乙醇可以与水互溶是因为它与水分子间可以形成氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com