

| 反应 | △H/kJ•mol-1 | △S/J•K-1•mol-1 |
| ① | -72.1 | +220 |
| ② | +149 | +41 |
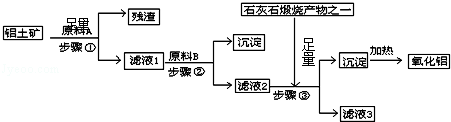
分析 钛铁矿(主要成分为FeTiO3,含少量Fe2O3)制备钛,钛铁矿加入过量焦炭在高温下还原生成铁和粗TiO2,加入过量焦炭在高温下氯化反应生成TiCl4,加入还原剂还原生成金属钛,酸洗后得到海绵钛;
(1)增大接触面积加快反应速率;
(2)步骤Ⅰ中所发生的主要反应是FeTiO3在高温下被碳还原生成二氧化钛、铁,碳被氧化为一氧化碳;
(3)步骤Ⅱ中所发生的主要反应是二氧化钛和氯气、碳高温发生氧化还原反应生成四氯化钛和一氧化碳,加入焦炭后发生反应①,与反应②相比,△H减小,△S增大;
(4)TiCl4遇到水易发生水解,用盐酸洗涤粗Ti,除去表面的杂质;
(5)依据平衡常数的概念结合反应写出计算式计算平衡浓度得到;
(6)电解池的阴极上得电子反应还原反应生成金属钛.
解答 解:钛铁矿(主要成分为FeTiO3,含少量Fe2O3)制备钛,钛铁矿加入过量焦炭在高温下还原生成铁和粗TiO2,加入过量焦炭在高温下氯化反应生成TiCl4,加入还原剂还原生成金属钛,酸洗后得到海绵钛;
(1)进行步骤Ⅰ前,钛铁矿需要先粉碎成细颗粒,目的为增大接触面积增大反应速率,故答案为:增大反应速率;
(2)步骤Ⅰ中所发生的主要反应是FeTiO3在高温下被碳还原生成二氧化钛、铁,碳被氧化为一氧化碳,反应的化学方程式为:FeTiO3+C$\frac{\underline{\;1180℃-1200℃\;}}{\;}$ Fe+TiO2+CO↑;
故答案为:FeTiO3+C$\frac{\underline{\;1180℃-1200℃\;}}{\;}$ Fe+TiO2+CO↑;
(3)步骤Ⅱ中所发生的主要反应是二氧化钛和氯气、碳高温发生氧化还原反应生成四氯化钛和一氧化碳,①的化学方程式为:TiO2+2Cl2+2C $\frac{\underline{\;800℃-900℃\;}}{\;}$ TiCl4+2CO,图表数据分析可知加入焦炭后发生反应①,与反应②相比,△H减小,△S增大,更有利于反应在较低温度下向右进行,
故答案为:TiO2+2Cl2+2C $\frac{\underline{\;800℃-900℃\;}}{\;}$ TiCl4+2CO;加入焦炭后发生反应①,与反应②相比,△H减小,△S增大,更有利于反应在较低温度下向右进行;
(4)步骤Ⅲ中,反应物TiCl4应避免接触水,原因为防止TiCl4水解,反应结束后,用盐酸洗涤粗Ti,除去Mg、MgCl2等杂质,制得海绵钛,
故答案为:防止TiCl4水解;Mg、MgCl2;
(5)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.79×10-39,反应Fe (OH)3+3H+?Fe3++H2O的平衡常数K=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=$\frac{c(F{e}^{3+})}{(\frac{1{0}^{-14}}{c(O{H}^{-})})^{3}}$=c(Fe3+)×c3(OH-)×1042=2.79×10-39×1042=2.79×103,故答案为:2.79×103;
(6)电解时,阴极上得电子发生还原反应,电极反应式为TiO2+4e-=Ti+2O2-,阳极上是氧离子失电子发生氧化反应产生氧气,电极反应为2O2--4e-=O2,
故答案为:TiO2+4e-=Ti+2O2-.
点评 本题考查学生阅读题目获取信息能力、氧化还原反应、绿色化学、胶体、物质分离提纯,平衡常数计算,溶度积常数的计算应用,盖斯定律的计算应用等,难度中等,注意基础知识的掌握利用.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )
一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )| A. | 该反应在0~8 min内CO2的平均反应速率是 0.375 mol•L-1•min-1 | |
| B. | 若起始时向上述容器中充入3 mol CO2和4 mol H2,则平衡时H2的体积分数大于20% | |
| C. | 若起始时向上述容器中充入4 mol CO2、2 mol H2、2 mol CH3OH和1mol H2O(g),则此时反应向正反应方向进行 | |
| D. | 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
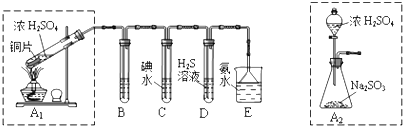
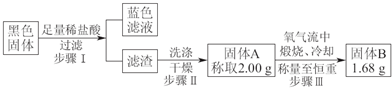
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LSO3所含的原子数为1.5NA | |
| B. | 常温常压下,1.8g H2O中含有的电子数为0.8NA | |
| C. | 常温常压下,48g O2和O3的混合物中含有的氧原子数为3NA | |
| D. | 标准状况下,0.1mol Cl2与足量NaOH溶液反应时,转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | KO2 | B. | K2O2 | C. | K2O3 | D. | K2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com