
【题目】在一定条件下发生反应 2SO3(g)![]() 2SO2(g)+O2(g),将2 mol SO3通入2 L容积恒定的密闭容器中,若维持容器内温度不变,5 min末测得SO3的物质的量为0.8 mol。则下列说法正确的是
2SO2(g)+O2(g),将2 mol SO3通入2 L容积恒定的密闭容器中,若维持容器内温度不变,5 min末测得SO3的物质的量为0.8 mol。则下列说法正确的是
A.若某时刻消耗了1 molSO3同时生成了0.5molO2,则表明该反应达到了平衡状态
B.若起始时充入3 mol SO3,起始时SO3分解速率不变
C.0~5min,SO2的生成速率v(SO2)=0.12mol·L-1·min-1
D.达到平衡时,SO2和SO3的浓度相等
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】如图是用铁铆钉固定两个铜质零件的示意图,若该零件置于潮湿空气中,下列说法正确的是
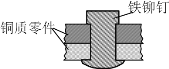
A.发生电化学腐蚀,铜为负极,铜极产生H2
B.铜易被腐蚀,铜极上发生还原反应,吸收O2
C.铁易被腐蚀,铁发生氧化反应,Fe-2e-=Fe2+
D.发生化学腐蚀:Fe + Cu2+ = Cu + Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列氧化还原反应:
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。
(1)该反应的还原剂是________,还原产物是________。
(2)该反应中氧化剂与氧化产物的物质的量之比是________。
(3)当有2 mol HNO3参加反应时,被氧化的物质是________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是一种应用广泛的金属,钠及其化合物在生产生活中应用广泛。某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。
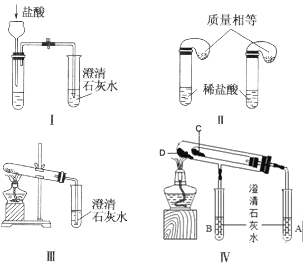
(1)只根据图中装置Ⅰ、Ⅱ所示实验,能够达到实验目的的是__(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式__、__;Ⅳ中现象为___;与实验Ⅲ相比,实验Ⅳ的优点___。
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管C中装入的固体是__(填化学式)。
(4)将适量钠投入下列溶液中,既能产生大量气体又能生成沉淀的是__(填写字母)
A.稀硫酸 B.氯化钠溶液 C.氯化镁溶液 D.硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若4.6 g Na在足量氧气中一段时间后,生成固体的质量为7.1 g,则生成的固体可能为( )
A.Na 和Na2OB.Na 和Na2O2C.Na 和Na2O2D.Na2O 和Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和铁都是生活中常用的金属。
(1)已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O。
①写出该反应的离子方程式__________________;
②用双线桥标出该反应电子转移的方向和数目___________________;
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
③若19.2g铜与足量硝酸完全反应,被还原的硝酸为______mol,氧化剂与还原剂物质的量之比为______。
(2)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①写出该反应的化学方程式___________________。
②检验溶液少量Fe3+存在的方法是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

下列说法不正确的是
A.“酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl- = Fe2++ TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C.“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑
2LiFePO4+H2O+3CO2↑
温度/ | 30 | 35 | 40 | 45 | 50 |
TiO2 ·xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
D.TiO2 ·xH2O沉淀与双氧水、氨水反应40min所得实验结果如上表所示, 40 oC前,未达到平衡状态,随着温度升高,转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成染料X和医药中间体Y。
已知:①![]() ②
②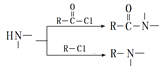 ③
③![]() ④
④![]() 。
。
(1)下列说法正确的是_________。
A.化合物A能与能与NaHCO3反应产生气体 B.X的分子式是C15H14Cl2O3N2
C.化合物C能发生取代、还原、加成反应 D.A→B,B→C的反应类型均为取代反应
(2)化合物D的结构简式是_________。
(3)写出E+H→F 的化学反应方程式__________________。
(4)写出化合物B(C10H10O4)同时符合下列条件的两种同分异构体的结构简式______________。
①与NaHCO3溶液反应,0.1mol该同分异构体能产生4.48L(标准状况下)CO2气体;②苯环上的一氯代物只有两种且苯环上的取代基不超过三个;③核磁共振氢谱有五种不同化学环境的氢,且峰面积比为1:2:2:2:3。
(5)设计以乙烯为原料合成制备Y(![]() )的合成路线________________(用流程图表示,无机试剂任选)。
)的合成路线________________(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究硫酸亚铁的分解产物,将硫酸亚铁样品装入下图的硬质玻璃管中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红棕色粉末。
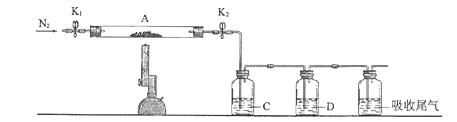
(1)C中的溶液为_______(填标号)。D中观察到的现象为___________。
a .品红 b .NaOH c. BaCl2 d. Ba(NO3)2 e. 浓H2SO4
(2)写出硫酸亚铁高温分解反应的化学方程式_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com