
已知:C(s)+CO2(g) 2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是(
)
2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是(
)
A.升高温度和减小压强 B.降低温度和减小压强
C.降低温度和增大压强 D.升高温度和增大压强
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:阅读理解
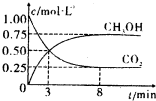 (2012?枣庄二模)碳和碳的化合物在人类生产、生活中的应用非常广泛,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(2012?枣庄二模)碳和碳的化合物在人类生产、生活中的应用非常广泛,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.| n(H2) | n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 13 |
| 2 |
| 13 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com