
分析 (1)依据m=cVM计算需要氢氧化钠的质量;
(2)氢氧化钠具有强烈的腐蚀性,应放在小烧杯中称量,称量时应先称量小烧杯,再加入药品,砝码增加10.0g,据此解答;
(3)容量瓶不能用来长期盛放溶液,配制完后应倒入细口瓶,用胶塞盖好保存;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制250ml 1.0mol/L NaOH溶液,需要氢氧化钠质量m=1.0mol/L×0.25L×40g/mol=10.0g,故答案为:10.0;
(2)氢氧化钠具有强烈的腐蚀性,应放在小烧杯中称量,正确的操作方法为:取小烧杯称其质量后,再增加10g砝码,然后将NaOH加到小烧杯中称量;
故答案为:取小烧杯称其质量后,再增加10g砝码,然后将NaOH加到小烧杯中称量;
(3)容量瓶不能用来长期盛放溶液,配制完后应倒入细口瓶,用胶塞盖好保存;
故答案为:第⑥步直接贴签保存是错误的,应该将溶液装入细口瓶中,用胶塞盖好保存;
(4)A.洗净的容量瓶中残留有少量水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故答案为:无影响;
B.转移过程中所用的烧杯、玻璃棒未洗涤,导致部分溶质损失,溶质的物质的量偏小,溶液浓度偏小,故答案为:偏小;
C.定容时俯视液面,导致溶液体积偏小,溶液浓度偏大,故答案为:偏大;
D.翻转摇匀后发现液面低于刻线又加入少许水调平,导致溶液体积偏大,溶液浓度偏小,故答案为:偏小.
点评 本题考查了配制一定物质的量浓度的溶液方法,明确配制原理及操作步骤是解题关键,注意依据C=$\frac{n}{V}$进行误差分析的方法,题目难度不大.


科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子.则该硫酸盐的物质的量浓度为
A.2 mol•L﹣1 B.7.5 mol•L﹣1 C.5 mol•L﹣1 D.2.5 mol•L﹣1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:填空题
(一题多变题组)关于物质的量各物理量之间的相互转化
(1)同温同压下,同体积的氨气(NH3)和硫化氢(H2S)气体的质量比为___________;同质量的氨气和硫化氢气体的物质的量比为_____________,所含原子个数比为__________;若两者所含氢原子数相等,它们的物质的量比是_____________。
(2)标准状况下,①4 g氢气、② 33.6 L甲烷、③ 6.02×10 23个水分子中,含分子数最多的是(填序号,下同)________,含原子数最多的是________,质量最大的是________,体积最小的是______。
23个水分子中,含分子数最多的是(填序号,下同)________,含原子数最多的是________,质量最大的是________,体积最小的是______。
(3)现有质量为a g某气体A2B,它的摩尔质量为M g/mol。若阿伏加德罗常数用NA表示,则:该气体的物质的量为_____ ___mol,该气体所含原子总数为___ ____个,该气体在标准状况下的体积为____________L。
(学法题)通过解答本题,在解题时应先将各种已知量转化为 再进行计算。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 3.48 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 1.58 | 158 |
| 硝酸银 | 0.02 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
VL Fe2(S O4)3溶液中含有Fe3+ m g,则溶液中SO42﹣的物质的量浓度为
O4)3溶液中含有Fe3+ m g,则溶液中SO42﹣的物质的量浓度为
A.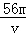 mol/L B.
mol/L B.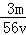 mol/L C.
mol/L C.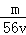 mol/L D.
mol/L D.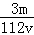 mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 消耗盐酸的体积/mL | 待测KOH溶液的体积/mL |
| 1 | 27.23 | 25.00 |
| 2 | 28.24 | 25.00 |
| 3 | 27.25 | 25.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com