
【题目】实验室里研究不同价态硫元素之间的转化
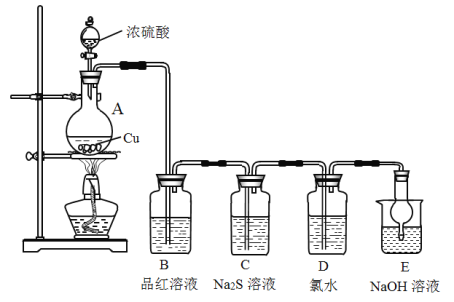
(1)A中发生反应的化学方程式为__________。
(2)B中的现象是__________。
(3)C中的现象是__________,Na2S在反应中做__________剂。
(4)D中氯水褪色,此反应中硫元素的化合价由_____转化为______;甲认为可以补充一个实验进一步证明硫元素的价态转化,实验方案和现象为:取D中褪色后的溶液于试管中________。
(5)E的作用是__________,离子方程式为__________。
(6)上述实验体现SO2的性质有__________。
【答案】Cu + 2 H2SO4(浓)![]() CuSO4 + SO2↑+ 2 H2O 品红溶液褪色 有淡黄色沉淀生成 还原 +4 +6 向其中加入BaCl2溶液(可以不加“盐酸酸化”),有白色沉淀生成 吸收SO2尾气,防止污染环境 SO2 + 2OH-= SO32- + H2O 漂白性、氧化性、还原性、酸性氧化物通性
CuSO4 + SO2↑+ 2 H2O 品红溶液褪色 有淡黄色沉淀生成 还原 +4 +6 向其中加入BaCl2溶液(可以不加“盐酸酸化”),有白色沉淀生成 吸收SO2尾气,防止污染环境 SO2 + 2OH-= SO32- + H2O 漂白性、氧化性、还原性、酸性氧化物通性
【解析】
该实验的目的是研究不同价态硫元素之间的转化;A为SO2的发生装置,B为检验SO2的装置,C中Na2S和SO2发生氧化还原反应生S沉淀,D中SO2和Cl2以及水反应生成H2SO4,E是吸收多余SO2的装置。
(1)A中Cu和浓硫酸反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)B为检验SO2的装置,现象是品红溶液褪色;
(3)C中,Na2S和SO2发生反应:2Na2S+SO2+2H2O=3S↓+4NaOH,故可观察到有淡黄色沉淀生成,该反应中,Na2S中S的化合价由-2价升为0价,故Na2S作还原剂;
(4)D中,Cl2和SO2发生反应:Cl2+SO2+2H2O=2HCl+H2SO4,S由+4价变为+6价;要想证明硫元素的价态转化,只需要证明产物中有SO42-即可,由于产物中已经有HCl,故只需要取D中褪色后的溶液于试管中,加入BaCl2溶液即可,对应的现象是有白色沉淀生成;
(5)E的作用是吸收SO2尾气,防止污染环境;离子方程式为:SO2+2OH-= SO32-+H2O
(6)B中现象体现SO2的漂白性,C中现象体现SO2的氧化性,D中现象体现SO2的还原性,E中现象体现酸性氧化物的通性。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,发生反应:![]() 。当下列所给有关量不再变化时,不能表明该反应已达平衡状态的是
。当下列所给有关量不再变化时,不能表明该反应已达平衡状态的是![]()
![]()
A.混合气体的压强B.混合气体的密度
C.混合气体的平均相对分子质量D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。
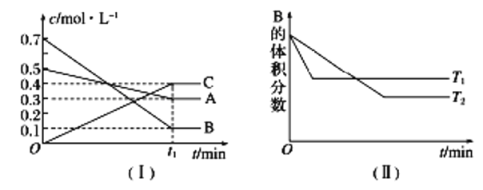
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为________,正反应为_____(填“吸热”或“放热”)反应。
(2)t1 min后,改变下列某一条件,能使平衡向逆反应方向移动的有______(填字母序号)。
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.保持其他条件不变,升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2+能与NH3、H2O、OH﹣、Cl﹣等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2+中的配位键__。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有__(填序号)。
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(2)金属铜单独与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生如下反应:Cu+H2O2+4NH3═[Cu(OH)4]2++2OH﹣。其原因是_________________.
(3)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图):

①H、O、N三种元素的电负性从大到小的顺序____。
②乙二胺分子中N原子成键时采取的杂化类型是__。
③乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制取乙烯,并用来验证乙烯化学性质的实验装置,其中B中盛放的是溴水,C中盛放的是酸性KMnO4溶液。
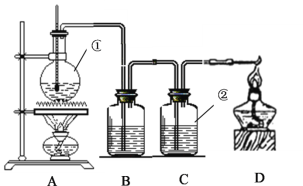
(1)写出①中发生反应的化学方程式____________________________________,
(2)B瓶中的现象是__________________,C瓶中的现象是__________________,这两种现象可以证明乙烯是_____________。(填“饱和烃”或“不饱和烃”)
(3)写出B瓶中发生反应的方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol
C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol
2C(s)+O2(g)=2CO(g)△H3=-221kJ/mol
若某反应的平衡常数表达式为:K=[c(N2) ·c2(CO2)]/[c2(NO) ·c2(CO)],则此反应的热化学方程式为____________________________________。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
t/min | 0 | 1 | 2 | 3 | 4 | 5 |
c(N2O5)/<mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为p0,第2min时体系压强为p1,则p1∶p0=__________。2~5min内用NO2表示的该反应的平均反应速率为__________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是__________。(填字母)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)![]() NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用k正、k逆表示)。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用k正、k逆表示)。
(4)如图是密闭反应器中按n(N2) ∶n(H2)=1∶3投料后,在200℃、400℃、600℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
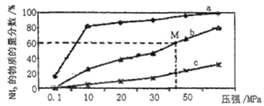
①曲线a对应的温度是__________。
②M点对应的H2的转化率是__________。
(5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:______________________________________________。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸三碳酰肼合镍{[Ni(CHZ)3](C104)2}是一种新型的起爆药。
(1)Ni2+核外电子排布式为___。
(2)ClO4-空间构型是___;与ClO4-互为等电子体的一种分子为___(填化学式)。
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为___;C、N、O三种元素的电负性由大到小的顺序为___。
(4)高氯酸三碳酰肼合镍可由NiO、髙氯酸及碳酰肼化合而成。NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为___。
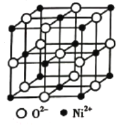
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,被美国食品药品监督管理局批准为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:

回答下列问题:
(1)A的名称为_______,E中官能团名称为________。
(2)B的结构简式为________。
(3)由C生成D的化学方程式为_________
(4)⑤的反应类型为______,⑧的反应类型为_________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有__________种。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应
其中核磁共振氢谱为五组峰的结构简式为_________。
(6)参照上述合成路线,设计一条由苯酚(![]() )、乙酸酐(CH3CO)2O和苯甲醛(
)、乙酸酐(CH3CO)2O和苯甲醛(![]() )为原料,制备
)为原料,制备 的合成路线(其他无机试剂任选)_____。
的合成路线(其他无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸(结构如图所示)为柳树皮提取物之一,是一种天然的消炎药,主要作为医药工业的原料。下列关于水杨酸的叙述错误的是( )
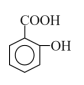
A.分子式为C7H6O3
B.能发生加成、酯化、中和等反应
C.苯环上的二氯取代物有5种
D.所有原子均可能在同一平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com