
传统合成氨工业需要采用高温、高压和催化剂.近来美国化学家使用新型铁系催化剂,在常温下合成了氨气.下列说法正确的是()
A. 新型合成氨方法是吸热反应
B. 新型合成氨方法可简化生产设备
C. 新型催化剂提高了N2和H2的转化率
D. 两种方法中该反应的化学平衡常数相同
考点: 工业合成氨.
专题: 化学平衡专题.
分析: A.根据盖斯定律可知,反应过程中吸收、放出的热量与反应途径无关,所以两种合成氨的焓变相同,都一定是放热反应;
B.在常温常压下合成出氨,可节约大量能源,能够节能减排;
C.使用催化剂能够改变反应速率,但是不会影响化学平衡,所以催化剂不会改变当前和氢气的转化率;
D.化学平衡常数受反应温度的影响,反应温度不同,化学平衡常数则不同.
解答: 解:A.反应热与反应途径无关,所以旧法合成氨与新法合成氨都是放热反应,故A错误;
B.与旧法相比较,新法合成氨不需要在高温条件下,可节约大量能源,简化生产设备,具有发展前景,故B正确;
C.催化剂只能改变反应速率,对反应物的转化率没有影响,所以新型催化剂不会提高N2和H2的转化率,故C错误;
D.化学平衡常数与反应温度有关,两种方法的反应温度不同,则化学平衡常数一定不同,故D错误;
故选B.
点评: 本题考查了化学平衡及其影响因素,题目难度中等,注意掌握温度、难度、催化剂等对化学平衡的影响,明确催化剂不会影响化学平衡及反应物的转化率、化学平衡常数与温度相关,温度不同,则化学平衡常数不同.


 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
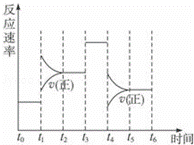
在一密闭体系中发生下列反应A(g)+3B(g)⇌2C(g)△H<0,如图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
(1)t1、t3、t4时刻体系中所改变的条件可能是: 、 、 ;
(2)C体积分数最高的时间段是 .(填“tx﹣ty”)
查看答案和解析>>
科目:高中化学 来源: 题型:
将标准状况下的VL HCl(气)溶于水配成1L溶液,得到的盐酸密度为ρg/cm3,则该盐酸的物质的量浓度为()
A. 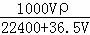 mol/L B.
mol/L B.  mol/L
mol/L
C.  mol/L D.
mol/L D. 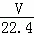 mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
CO(g)+H2O(g)⇌H2(g)+CO2(g)△H<0,在其他条件不变的情况下()
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
认真观察下列装置,回答下列问题:
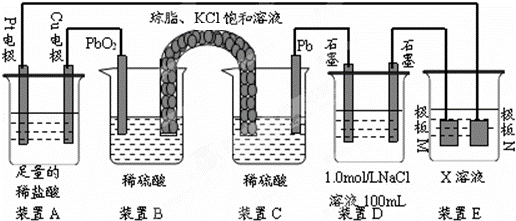
(1)装置B中PbO2上发生的电极反应方程式为 .
(2)装置A中总反应的离子方程式为 .
(3)若装置E中的目的是在Cu材料上镀银,则X为 ,极板N的材料为Ag.若装置E的目的是验证金属的电化学防腐,则极板N的材料为 .
(4)当装置A中Cu电极质量改变6.4g时,装置D中产生的气体体积为 L(标准状况下).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
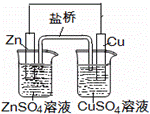
A. 电镀时,通常把待镀的金属制品作阴极
B. 氢氧燃料电池(酸性电解质)中O2通入负极
C. 图中电子由Cu极流向Zn,盐桥中的Cl﹣移向CuSO4溶液
D. 在海轮外壳镶嵌锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
在某2L恒容密团容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)⇌3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示:下列推断正确的是()
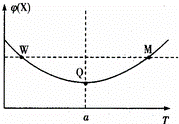
A. 升高温度,平衡常数增大
B. W点Y的正反应速率等于M点Y的正反应速率
C. Q点时,Y的转化率最大
D. 平衡时充入Z.达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取时,要收集干燥纯净的氯气,应使氯气依次通过( )
|
| A. | 水、浓H2SO4 | B. | 饱和Na2CO3溶液、浓H2SO4 |
|
| C. | 饱和NaCl溶液、浓H2SO4 | D. | 饱和NaHCO3溶液、浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁电池是一种新型可充电电池,该电池长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是()
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是()
A. 放电时负极反应为:Zn﹣2e﹣+2OH﹣=Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3﹣3e﹣+5OH﹣=FeO42﹣+4H2O
C. 放电时每转移1 mol电子,正极有1mol K2FeO4被还原
D. 放电时正极附近溶液的pH值升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com