
【题目】下列图示与对应的叙述相符的是
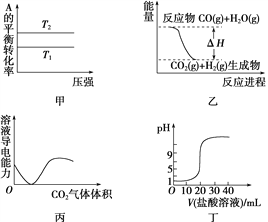
A. 由图甲可以判断:对于反应A(g)+B(g) ![]() 2C(g),若T1>T2,则ΔH<0
2C(g),若T1>T2,则ΔH<0
B. 图乙表示可逆反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH>0
CO2(g)+H2(g) ΔH>0
C. 图丙表示CO2通入饱和Na2CO3溶液中,溶液导电性变化
D. 图丁表示0.1 mol·L-1的盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液pH随加入盐酸体积的变化
【答案】A
【解析】A.升高温度A的转化率减小,平衡逆向移动,正反应是放热反应,所以△H<0,故A错误;B.由图示可知反应物的总能量大于生成物,反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)为放热反应,即ΔH<0,故B错误;C.因CO2通入饱和Na2CO3溶液中会有部分NaHCO3晶体析出,导致溶液导电性降低,但完全反应时溶液为饱和碳酸氢钠溶液,导电性不可能为0,继续通入过量的CO2后,导电性会略有增加,因有少量碳酸生成,但不可能比最初导电性强,故C错误;D.用0.1mol/L的盐酸滴定20mL0.1mol/LNaOH溶液,未滴入盐酸时开始pH为13,随着盐酸的滴入,溶液的pH逐渐降低,故D错误;答案为A。
CO2(g)+H2(g)为放热反应,即ΔH<0,故B错误;C.因CO2通入饱和Na2CO3溶液中会有部分NaHCO3晶体析出,导致溶液导电性降低,但完全反应时溶液为饱和碳酸氢钠溶液,导电性不可能为0,继续通入过量的CO2后,导电性会略有增加,因有少量碳酸生成,但不可能比最初导电性强,故C错误;D.用0.1mol/L的盐酸滴定20mL0.1mol/LNaOH溶液,未滴入盐酸时开始pH为13,随着盐酸的滴入,溶液的pH逐渐降低,故D错误;答案为A。


科目:高中化学 来源: 题型:
【题目】有机物在反应中,常有下列原子间的共价键全部或部分断裂,如C﹣H、C﹣C、C=C、C﹣O、C=O、O﹣H.下列各反应中,反应物分子中断裂键的排列,正确的组合是( )
化学反应 | 加成反应 | 乙酸酯化 | 乙醇酯化 | 乙醇的催化氧化 | 加聚反应 |
① | C=C | C﹣O | O﹣H | C﹣H | C=C |
② | C=C | C﹣O | O﹣H | C=O | C﹣H |
③ | C﹣C | C=O | C﹣O | C﹣H | C=O |
④ | C=C | C﹣O | C﹣O | C﹣C | C=O |
A. ① B. ② C. ③ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A2 + 3B2=2C的反应,在不同条件下的化学反应速率表示中,反应速率最快的是( )
A. v(B2) =0.8mol/(Ls) B. v(A2) =0.4mol/(Ls)
C. v(C) =0.6mol/(Ls) D. v(B2) =4.2mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池的装置如图所示,看到a极上有红色金属析出,回答下列问题: 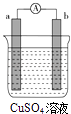
①若a、b是两种活动性不同的金属,则活动性ab(填>、<或=);
②电路中的电子从经导线流向(填a或b);
③溶液中的SO42﹣向极移动(填a或b);
④若两电极分别是Al和C,则负极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对物质性质的研究是一种科学探究的过程,这种研究过程的科学组合应该是( )
A. 预测物质的性质→观察物质的外观→实验和观察→解释和结论
B. 观察物质的外观→预测物质的性质→解释和结论→实验和观察
C. 预测物质的性质→观察物质的外观→解释和结论→实验和观察
D. 观察物质的外观→预测物质的性质→实验和观察→解释和结论
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
( )
a | b | c | |
A | Al | AlCl3 | Al(OH)3 |
B | HNO3 | NO | NO2 |
C | Si | SiO2 | H2SiO3 |
D | CO2 | Na2CO3 | NaHCO3 |
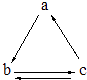
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.利用铝的还原性和铝转化为氧化铝时能放出大量的热的性质,工业上常用铝粉还原一些金属氧化物
B.单质碳有还原性,在高炉炼铁中直接将氧化铁还原成铁
C.研制出性能优良的催化剂可以使反应温度降低,提高反应速率,从而起到很好的节能效果
D.太阳能电池板可将光能转换为电能,所用转换材料是硅晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用如下装置(夹持和加热仪器已略去)电解饱和食盐水,并检验氯气的氧化性,同时用电解产生的H2还原CuO粉末来测定Cu的相对原子质量。
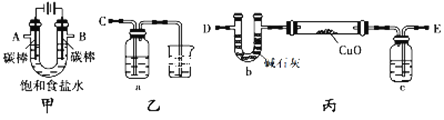
(1)写出电解饱和食盐水的离子方程式_________________________________。
(2)为完成上述实验,正确的连接顺序为A连_______;B连_______ (填写导管口字母)。
(3)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是下列试剂中的___________。
a.酸性高锰酸钾溶液 b.淀粉碘化钾溶液 c.亚硫酸钠溶液 d.氯化亚铁溶液
(4)丙装置的c瓶中盛放的试剂为___________,作用是______________________。
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案:
精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g(假设CuO充分反应),实验完毕后:
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量。
乙方案:通过精确测定U型管b反应前后的质量变化,得到生成水的质量d g,进而确定Cu的相对原子质量。
①请你分析并回答:___________方案所测结果更准确。若按合理方案测定的数据计算,Cu的相对原子质量为________________。
②不合理的方案会造成测定结果___________(填“偏低、偏高或无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下:提出猜想
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜也有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
实验探究
(1)I.解决问题1
a.需用到的药品除1molL﹣1CuSO4溶液、稀硫酸外还需________(填试剂的化学式)溶液.
b.用胆矾晶体配制1molL﹣1CuSO4溶液250mL,选用的仪器除烧杯、托盘天平、药匙、
玻璃棒、胶头滴管外,还有________(填仪器名称).
c.为达到实验目的,请你补全实验内容和步骤:
①用CuSO4溶液制备Cu(OH)2;
②________.
(2)Ⅱ.解决问题2
取一定量I中制备获得的氢氧化铜固体于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在.根据以上实验现象回答问题.
a.写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:________.
b.从实验Ⅱ可得出的结论是在高温下正一价铜比正二价铜________(填稳定或不稳定),溶液中正一价铜比正二价铜________(填稳定或不稳定).
(3)Ⅲ.解决问题3设计如下装置(夹持装置未画出):

当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的单质气体Y;将X通人灼热的CuO燃烧管完全反应后,消耗0.01mol X,测得B装置增重0.36g,并收集到0.28g气体Y.
a.仪器A的名称是________.
b.X的化学式为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com