
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
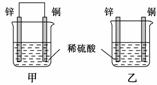
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速率甲比乙慢
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
铁、铜等金属及其化合物在日常生产生活中用途非常广泛。
Ⅰ.孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
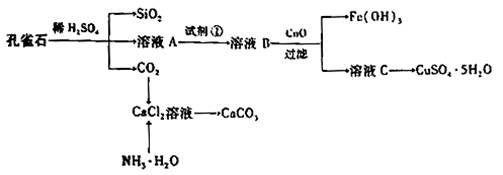
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+:从下列所给试剂中选择:实验步骤中试剂①为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
a.KMnO4 b. (NH4) 2S c. H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过 等操作。
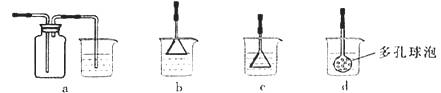
(3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入) (填化学式)。若实验过程中有氨气逸出、应选用下列 装置回收(填代号)。
Ⅱ.(1)某同学欲从含FeCl3、FeCl2、CuCl2的废液中回收金属铜,取上述1L废液加入铁粉,充分反应。所加铁粉的物质的量与废液中铜离子的物质的量的关系曲线如图:
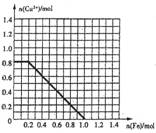 已知原废液中c(Cl-)=6.0mol.L-1,则原废液中c(Fe3+)= ,c(Fe2+)= 。(忽略水解及溶液体积变化)
已知原废液中c(Cl-)=6.0mol.L-1,则原废液中c(Fe3+)= ,c(Fe2+)= 。(忽略水解及溶液体积变化)
(2)现有Fe2O3、ZnO、CuO的混合固体粉末ag,在加热条件下用足量的CO还原,得到金属混合物2.41g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00g白色沉淀。请回答下列问题:
①a= 。
②若agFe2O3、ZnO、CuO的混合物总物质的量为bmol,则Fe2O3的物质的量为 。(用含b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列装置进行实验,设计正确且能达到实验目的的是
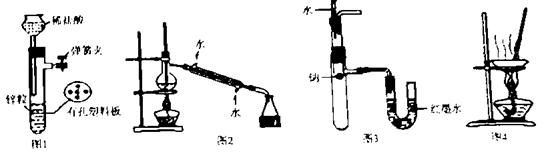
A.用图1所示装置制取少量H2
B.用图2所示装置分离Na2CO3溶液和CH3COO C2H5的混合物
C.用图3所示装置验证Na和水反应为放热反应
D.用图4所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
今有如下三个热化学方程式:
H2(g)+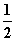 O2(g)===H2O(g) ΔH=a kJ·mol-1
O2(g)===H2O(g) ΔH=a kJ·mol-1
H2(g)+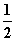 O2(g)===H2O(l) ΔH=b kJ·mol-1
O2(g)===H2O(l) ΔH=b kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH=c kJ·mol-1
下列关于它们的表述正确的是( )
A.它们都是吸热反应 B.a、b和c均为正值
C.a=b D.2b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列三个热化学方程式
①H2(g)+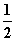 O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
③C(s)+H2O(g)===CO(g)+H2(g) ΔH=131 kJ·mol-1
写出碳燃烧生成CO和CO燃烧的热化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的SO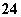 离子浓度逐渐增大
离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O====CH3COOH+4H+。下列有关说法正确的是( )
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
C.电池反应的化学方程式为:CH3CH2OH+O2====CH3COOH+H2O
D.正极上发生的反应是:O2+4e-+2H2O====4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
pH相同的盐酸溶液与醋酸溶液分别和锌粒反应,若最后锌都已完全溶解,放出的气体一样多,下列说法正确的是( )
A.反应所需时间:醋酸>盐酸
B.整个反应阶段的平均反应速率:醋酸>盐酸
C.开始的反应速率:盐酸>醋酸
D.参加反应的锌的质量:盐酸=醋酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com