
下列实验中,所采取的分离方法与对应原理都正确的是
| 选项 | 目的 | 分离方法 | 原理 |
| A. | 分离溶于水的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B. | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C. | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
| D. | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
科目:高中化学 来源: 题型:
下列反应的离子方程式中正确的是( )
A. 钠与水反应:2Na+2H2O=2Na++2OH﹣+H2↑
B. 氢氧化钡溶液和硫酸铵溶液反应:Ba2++SO42﹣=BaSO4↓
C. 硫化钠溶于水呈碱性:S2﹣+2H2O⇌H2S+2OH﹣
D. 向溴化亚铁溶液中通入少量氯气:Cl2+2Br﹣=2Cl﹣+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
利用催化氧化反应将SO2转化为SO3是工业上生产
硫酸的关键步骤.
(1)T1℃时,在1L密闭容器中充入0.6molSO3,图1表示SO3
物质的量随时间的变化曲线。
①平衡时,SO3的转化率为 (保留小数点后一位) ;
T1℃时,反应2SO2(g)+O2(g)  2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3
2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3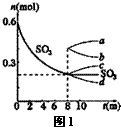 )的变化曲线为 (填字母)。
)的变化曲线为 (填字母)。
②下表为不同温度(T)下,反应2SO2(g)+O2(g)  2SO3(g) (△H<0)的化学平衡常数(K)
2SO3(g) (△H<0)的化学平衡常数(K)
| T/℃ | T2 | T3 |
| K | 20.5 | 4.68 |
由此推知,温度最低的是 (填“T1”、“T2” 或 “T3”)。
③在温度为T1℃时,向该1L的密闭容器中同时加入0.2molSO2、xmolO2、0.2molSO3三种气体,在达到平衡前若要使SO3的浓度减小,则x的取值范围是 。
(2)科学家研究出用电化学原理生产硫酸的新工艺,装置如图2所示,总反应的化学方程式为 ,其阳极的电极反应式为
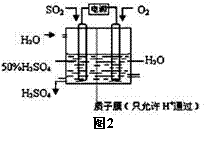 |
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2、NO是大气污染物。吸收SO2 和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
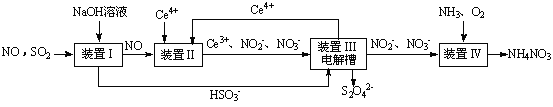
(1)装置Ⅰ中生成HSO3-的离子方程为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如右图所示。
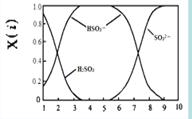
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
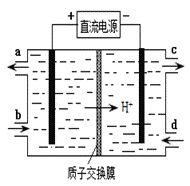
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式硫酸铁Fe(OH)SO4对水中的悬浮物、有机物、硫化物、重金属等都能絮凝,工业上常用硫酸亚铁法制备,工艺流程如下图所示:
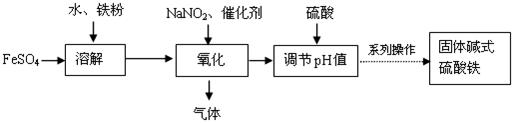
已知: Fe3+沉淀完全时的pH=3.1, Fe2+沉淀完全时的pH=9.7。
(1)请写出溶解过程中加快溶解速率和提高浸出率的两点措施:
_______________________________,______________________________。
(2)加入硫酸的作用是控制体系的pH值,若硫酸加入量过小,反应体系酸度太低,容易生成 沉淀;若硫酸加入量过大,不利于产品形成,试从平衡移动的角度分析原因是 。
(3)氧化过程中生成的气体遇空气变红棕色。写出氧化过程发生的离子方程式:
________________________________________________________________。
(4)流程图中的“系列操作”包括 , ,过滤,洗涤,烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作不正确的是
A.吸滤完毕停止吸滤时,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关闭水龙头全【品教学网, 用后离不了!
B.分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
C.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
D.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
查看答案和解析>>
科目:高中化学 来源: 题型:
实验时可用推拉注射器活塞
的方法检查右图中装置的气密性。当向外拉活塞时,如果装置气密性良
好,可能观察到

A.长颈漏斗下端管口产生气泡
B.瓶中液面明显上升
C.长颈漏斗内的液面上升
D.注射器内有液体
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用甲苯生产对羟基苯甲酸乙酯(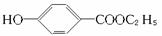 ),其过程如下:
),其过程如下:

据合成路线填写下列空白:
(1)有机物A的结构简式:____________________,B的结构简式:____________________。
(2)反应④属于____________反应,反应⑤属于______________反应。
(3)③和⑥的目的是______________________________________________。
(4)写出反应⑥的化学方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g)B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 3 | 8 |
| 总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 |
| 时间t/h | 16 | 20 | 25 | 30 | |
| 总压强p/100 kPa | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为________,平衡时A的转化率为________,列式并计算反应的平衡常数K________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总=________mol,n(A)=________mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为________ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com