
【题目】漂白粉能杀死禽流感病毒等。其稳定性比氯水高。
(1)工业上制取漂白粉的化学方程式为___________,漂白粉的有效成分是________________。
(2)漂白粉暴露在空气中易失效的主要原因是________________________________。(用化学方程式表示)
(3)有效氯是漂白粉中有效成分Ca(ClO)2含量大小的标志。
已知:①Ca(ClO)2+4HCl==CaCl2+2Cl2+2H2O;
②有效氯=![]() ×100%.若某漂粉精的有效氯为65%,该漂粉精中Ca(ClO)2的质量分数为________。
×100%.若某漂粉精的有效氯为65%,该漂粉精中Ca(ClO)2的质量分数为________。
【答案】 2Ca(OH)2+2Cl2![]() CaCl2+Ca(ClO)2+2H2O Ca(ClO)2 Ca(ClO)2+H2O+CO2
CaCl2+Ca(ClO)2+2H2O Ca(ClO)2 Ca(ClO)2+H2O+CO2![]() CaCO3+2HClO 2HClO
CaCO3+2HClO 2HClO![]() 2HCl+O2↑ 65.5%
2HCl+O2↑ 65.5%
【解析】(1)氯气与碱反应生成金属氯化物和次氯酸盐,工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,氯气和石灰乳[Ca(OH)2]反应生成氯化钙和次氯酸钙以及水,方程式为:2Ca(OH)2+2Cl2![]() CaCl2+Ca(ClO)2+2H2O;次氯酸盐是漂白杀毒剂的有效成分,漂白粉的有效成份是Ca(ClO)2;(3)漂白粉的漂白原理是:次氯酸钙与空气中的水和CO2作用生成的次氯酸是一种很好的杀菌消毒剂,故漂白粉暴露在空气中易失效的主要原因是Ca(ClO)2+H2O+CO2
CaCl2+Ca(ClO)2+2H2O;次氯酸盐是漂白杀毒剂的有效成分,漂白粉的有效成份是Ca(ClO)2;(3)漂白粉的漂白原理是:次氯酸钙与空气中的水和CO2作用生成的次氯酸是一种很好的杀菌消毒剂,故漂白粉暴露在空气中易失效的主要原因是Ca(ClO)2+H2O+CO2![]() CaCO3+2HClO、2HClO
CaCO3+2HClO、2HClO![]() 2HCl+O2↑;(3)反应中①Ca(ClO)2+4HCl==CaCl2+2Cl2+2H2O生成2 mol Cl2需要1 mol Ca(ClO)2,质量为143 g,而漂粉精的质量=
2HCl+O2↑;(3)反应中①Ca(ClO)2+4HCl==CaCl2+2Cl2+2H2O生成2 mol Cl2需要1 mol Ca(ClO)2,质量为143 g,而漂粉精的质量=![]() =218.5 g,所以Ca(ClO)2的质量分数=
=218.5 g,所以Ca(ClO)2的质量分数=![]() ×100%=65.5%。
×100%=65.5%。


科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示。

(1)装置C的作用是___________________________。
(2)①设计实验方案检验有Fe2+生成:______________________________________________。
②证明SO2气体还原I2的现象:_______________________________________________________________。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤为蒸发浓缩、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有________(填字母)。
A.蒸发皿 B.试管夹C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化是实施节能环保的一项重要措施。通常在高温下将煤转化为水煤气,再将水煤气作为气体燃料。有关热化学方程式如下:
①C(s)+H2O(g)![]() CO(g)+H2(g) ΔH1=+131.3 kJ·mol1
CO(g)+H2(g) ΔH1=+131.3 kJ·mol1
②2CO(g)+O2(g)![]() 2CO2(g) ΔH2=566.0 kJ·mol1
2CO2(g) ΔH2=566.0 kJ·mol1
③2H2(g)+O2(g)![]() 2H2O(g) ΔH3=483.6 kJ·mol1
2H2O(g) ΔH3=483.6 kJ·mol1
下列有关说法正确的是
A.水煤气只能用作燃料
B.水煤气是一种二级能源,比煤直接燃烧污染小
C.等质量的CO和H2完全燃烧时,前者放热多
D.由③反应可以确定H2的燃烧热为241.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键的下列叙述中,不正确的是 ( )
A. 离子化合物可能含共价键 B. 共价化合物一定含共价键
C. 离子化合物中只含离子键 D. 共价化合物中不含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积恒定的密闭容器中,一定量的SO2与1.100molO2在催化剂作用下加热到600℃发生反应:2SO2+O2![]() 2SO3;△H<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同的温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
2SO3;△H<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同的温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
A. 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B. 降低温度,正反应速率减小程度比逆反应速率减小程度大
C. 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980g
D. 达到平衡时,SO2的转化率是90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为________________。
(2)四种元素中第一电离能最小的是_________,电负性最大的是_______ (填元素符号)
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
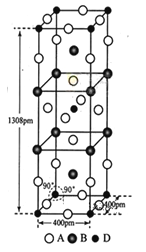
①该化合物的化学式为_______________; D的配位数为_____________;
②列式计算该晶体的密度___________g·cm-3
(4)A-、B+和C3+三种离子组成的化合物的B3CA6,其中化学键的类型有________ ;该化合物中存在一个复杂离子,该离子的化学式为_____________,配位体是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是
A.D>C>A>B
B.D>A>B>C
C.D>B>A>C
D.B>A>D>C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com