
【题目】铁是目前人类使用量最大的金属,它能形成多种化合物。
(1)取5.6g生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集的气体体积均小于2.24L(标准状况),最主要的原因是___;所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因:___。
(2)ZnFe2O4是一种新型纳米材料,可将工业废气中的CO转化为CO2,则ZnFe2O4中Fe元素的化合价为___。ZnFe2O4和CO在1200℃发生反应:6ZnFe2O4+2CO![]() 6ZnO+2CO2+aM(其中a为化合物M的化学计量数),则M的化学式为___,反应中ZnFe2O4作___剂。
6ZnO+2CO2+aM(其中a为化合物M的化学计量数),则M的化学式为___,反应中ZnFe2O4作___剂。
(3)LiFePO4是锂离子电池材料之一。以FePO4、Li2CO3和单质碳为原料在高温下制备LiFePO4,该反应还生成一种可然性气体,则反应的化学方程式为___。
【答案】生铁中含有碳元素等物质 4Fe2++O2+4H+=4Fe3++2H2O +3 Fe3O4 氧化 2FePO4+Li2CO3+2C![]() 2LiFePO4+3CO↑
2LiFePO4+3CO↑
【解析】
(1)生铁中含有碳元素等物质,故5.6g铁的物质的量少于0.1mol,生成的氢气的体积少于2.24L(标准状况);变黄色说明有Fe3+生成,是由Fe2+被氧气氧化所导致的,其反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O;故答案为:生铁中含有碳元素等物质;4Fe2++O2+4H+=4Fe3++2H2O;
(2)ZnFe2O4中Zn是+2价,O是-2价,则根据化合价代数和为0可知Fe元素的化合价为+3价,根据质量守恒定律,M为:Fe3O4,a=4,反应中ZnFe2O4作Fe元素化合价由+3价降低为+2价,发生还原反应,ZnFe2O4作氧化剂,故答案为:+3;Fe3O4;氧化;
(3)FePO4、Li2CO3和单质碳为原料在高温下制备LiFePO4,其反应的化学方程式为:2FePO4+Li2CO3+2C![]() 2LiFePO4+3CO↑,故答案为:2FePO4+Li2CO3+2C
2LiFePO4+3CO↑,故答案为:2FePO4+Li2CO3+2C![]() 2LiFePO4+3CO↑。
2LiFePO4+3CO↑。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知有机物A、B、C、D、E、F、G有如图转化关系,其中C的产量可用来衡量一个国家的石油化工发展水平,G的分子式为![]() ,试回答下列有关问题。
,试回答下列有关问题。
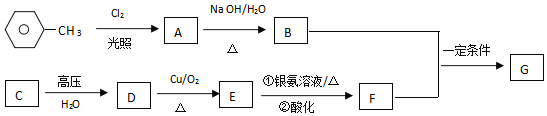
(1)G的结构简式为______。
(2)C转化为D的反应类型:______。
(3)写出B和F反应生成G的化学方程式:______。
(4)写出同时符合下列条件的G的同分异构体结构简式______、______。
①苯环上有3个取代基,且有两个取代基相同;
②能够与新制的银氨溶液反应产生光亮的银镜;
③核磁共振氢谱共有4种吸收峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钼(Mo)的晶胞如图所示,钼原子半径为apm,相对原子质量为M,以NA表示阿伏加德罗常数的值。
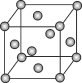
(1)钼晶体的堆积方式为__。
(2)钼原子的配位数为__。
(3)构成钼晶体的粒子是__。
(4)金属钼的密度为__g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态碳原子的核外电子排布式为______。
(2)基态铬原子外围电子轨道表示式为___。
(3)卤族元素F、Cl的电负性由小到大的顺序是______。
(4)比较晶格能:MgO___MgS(用“>”、“<”)
(5)CO分子内σ键与π键个数之比为________。
(6)比较第一电离能:Mg___Al(用“>”、“<”)
(7)乙炔是________(填“非极性”或“极性”)分子。
(8)丙烯(CH3CH=CH2)分子中碳原子的杂化方式为________和________。
(9)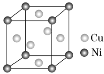 某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为________。
某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),
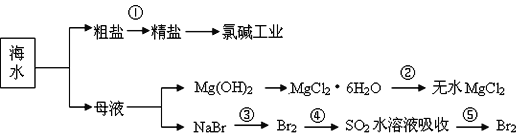
下列有关说法正确的是
A.第①步中除去粗盐中的![]() 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为: Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤→适量盐酸调pH
、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为: Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤→适量盐酸调pH
B.MgSO4·7H2O在空气中加热可制得无水MgSO4的方法与第②步相似。
C.从第③步到第⑤步的目的是为了浓缩富集Br2
D.在第③④⑤步中溴元素均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.碳酸氢铵溶液中加入足量的浓氢氧化钠溶液并加热:NH![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
B.铜与稀硝酸的反应:Cu+4H++2NO![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
C.向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO![]() =BaSO4↓+H2O
=BaSO4↓+H2O
D.过量二氧化硫与氢氧化钠溶液反应:SO2+OH-=HSO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L密闭容器中充入4 mol A气体和3 mol B气体,发生下列反应:2A(g)+B(g)![]() C(g)+xD(g),5 s达到平衡。达到平衡时,生成了1 mol C,测定D的浓度为1 mol·L-1。
C(g)+xD(g),5 s达到平衡。达到平衡时,生成了1 mol C,测定D的浓度为1 mol·L-1。
(1)求x=_____。
(2)求这段时间A的平均反应速率为_____。
(3)平衡时A的转化率为_____。
(4)下列叙述能说明上述反应达到平衡状态的是_____
A. 单位时间内每消耗2 mol A,同时生成1 mol C
B. 单位时间内每生成1 molB,同时生成1 molC
C. D的体积分数不再变化
D. 混合气体的压强不再变化
E. B、C 的浓度之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池应用很广。某种锂离子二次电池的电极材料主要是钴酸锂(LiCoO2)和石墨。钴是一种稀有的贵重金属,废旧锂离子电池电极材料的回收再生意义重大。
(1)锂离子电池(又称锂离子浓差电池)的充电过程:Li+从含LiCoO2的电极中脱出,正三价Co被氧化,此时该极处于贫锂态(Li1-xCoO2)。
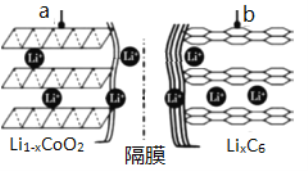
①充电时,a极的电极反应式为____________________________________。
②放电时,电流从______(填“a”或“b”)极流出。
(2)钴酸锂回收再生流程如下:
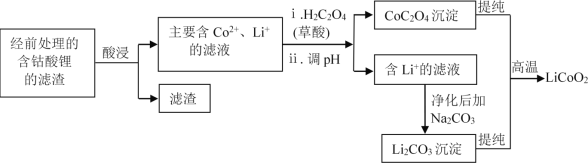
①H2SO4酸浸时,通常添加30%的H2O2以提高浸出效率,其中H2O2的作用是_______________。
②用盐酸代替H2SO4和H2O2,浸出效率也很高,但工业上不使用盐酸,主要原因之一是:会产生有毒、有污染的气体。写出相应反应的化学方程式______________________________。
③高温下,在O2存在时纯净的CoC2O4与Li2CO3再生为LiCoO2的化学方程式为_______________。
(3)已知下列热化学方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a. 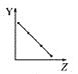 b.
b. 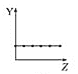 c.
c. 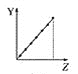 d.
d. 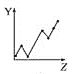
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com