
| A. | 酸性 HClO4>HNO3>H3PO4>H2SiO3 | B. | 稳定性H2S>HCl>HBr>HI | ||
| C. | 熔点 Rb>K>Na>Li | D. | 溶解性NaHCO3>Na2CO3>NaOH |
分析 A.元素的非金属性越强,它的最高价氧化物的水化物酸性越强;
B.元素的非金属性越强,对应的氢化物越稳定;
C.碱金属单质的熔点随着原子序数的递增而逐渐降低;
D.常温时,NaHCO3与Na2CO3相比较,Na2CO3溶解度较大.
解答 解:A.元素的非金属性越强,它的最高价氧化物的水化物酸性越强,非金属性Cl>N>P>Si,所以酸性:HClO4>HNO3>H3PO4>H2SiO3,故A正确;
B.非金属性Cl>S,元素的非金属性越强,对应的氢化物越稳定,则HCl>H2S,故B错误;
C.碱金属单质的熔点随着原子序数的递增而逐渐降低,即熔点:Rb<K<Na<Li,故C错误;
D.常温时,NaHCO3与Na2CO3相比较,Na2CO3溶解度较大,溶解度:Na2CO3>NaHCO3,故D错误;
故选A.
点评 本题考查元素周期律知识,为高频考点,侧重于学生的分析能力的考查,注意把握判断的角度,注重相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,该配离子不存在的化学键类型类型有( )
,该配离子不存在的化学键类型类型有( )| A. | 配位键 | B. | 极性键 | C. | 离子键 | D. | 非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
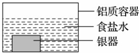 银制器皿表面日久因生成 Ag2S 而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去.有关说法正确的是
银制器皿表面日久因生成 Ag2S 而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去.有关说法正确的是| A. | 该处理过程中电能转化为化学能 | B. | 银器为正极,Ag2S 还原为单质银 | ||
| C. | 铝质容器为阳极,其质量变轻 | D. | Ag2S 溶解于食盐水生成了 AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=4.8 mol/(L•min) | B. | v(A2)=1.5 mol/(L•s) | ||
| C. | v(C)=1.6 mol/(L•s) | D. | v(B2)=1.7 mol/(L•s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com