
| A. | 相同物质的量浓度的NaA、HA混合溶液呈碱性 | |
| B. | 提高CO2兖气压力,碳酸饮料中c (A-)减小 | |
| C. | 当碳酸饮料的pH为5.0时,$\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| D. | 碳酸饮料中各粒子的浓度关系为c( H+)=c( HCO3-)+2c( CO32-)+c(OH-)-c(HA) |
分析 A.NaA溶液中水解平衡常数和HA电离平衡常数比较判断水解程度和电离程度大小判断溶液酸碱性;
B.酸性增强,溶液中c(A-)减小;
C.$\frac{c(HA)}{c({A}^{-})}$=$\frac{c({H}^{+})}{Ka}$计算;
D.根据质子守恒分析,c(H+)+c(HA)=c(HCO3-)+2c(CO32-)+c(OH-).
解答 解:A.NaA溶液中水解平衡,A-+H2O?HA+OH-,平衡常数Kh=$\frac{c(HA)c(O{H}^{-})}{c(HA)}$=$\frac{c(HA)c(O{H}^{-})}{c(HA)}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{6.25×1{0}^{-5}}$=1.6×10-10<Ka=6.25×10-5 ,电离程度大,如显酸性,故A错误;
B.提高CO2充气压力,溶液的酸性增强,溶液中c(A-)减小,故B正确;
C.当pH为5.0时,饮料中$\frac{c(HA)}{c({A}^{-})}$=$\frac{c({H}^{+})}{Ka}$=$\frac{1{0}^{-5}}{6.25×1{0}^{-5}}$=0.16,故C正确;
D.碳酸饮料中碳酸电离的氢离子与水电离的氢离子之和等于溶液中氢离子与A-结合的氢离子之和,即溶液中存在质子守恒:c(H+)+c(HA)=c(HCO3-)+2c(CO32-)+c(OH-),则各种粒子的浓度关系为:c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(HA),故D正确;
故选A.
点评 本题考查了溶液中离子浓度大小比较、电离常数的有关计算等,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握电离常数的计算方法.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
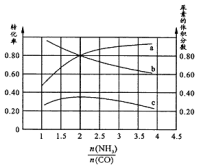 用CO合成尿素的反应为:2NH3(g)+CO(g)?CO(NH2)2(g)+H2(g)△H<0.
用CO合成尿素的反应为:2NH3(g)+CO(g)?CO(NH2)2(g)+H2(g)△H<0.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO-中氯元素显+1价,具有很强的还原性 | |
| B. | 这些离子结合H+的能力,ClO4-最强 | |
| C. | ClO3-是NO3-的等电子体,其空间构型为平面三角形 | |
| D. | ClO2-、ClO3-、ClO4-中的氯原子都采取sp3杂化,离子中相邻两个Cl-O键间键角依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 )有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是
)有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是 、
、 、
、 任意2种(写出任意2种的结构简式)
任意2种(写出任意2种的结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOCH3 | B. | CH3COCH3 | C. | C6H5OH | D. | CH2=CH-CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
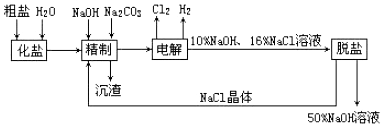
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入稀硫酸 NH3+H+═NH4+ | |
| B. | 稀烧碱溶液和氯化铵溶液混合 NH4++OH-═NH3•H2O | |
| C. | 碳酸氢铵和足量浓烧碱溶液混合加热 NH4++OH-═NH3↑+H2O | |
| D. | Cl2和水反应 Cl2+H2O═H++Cl-+HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com