
【题目】29Si的原子核内的中子数与核外电子数之差是( )
A. 5B. 4C. 1D. 2
科目:高中化学 来源: 题型:
【题目】下列各物质的转化关系如下图所示.B、D是气体,其中B是空气的主要成分之一;C是淡黄色固体,常用于供氧剂;E是红棕色固体;F是最常见的无色液体. 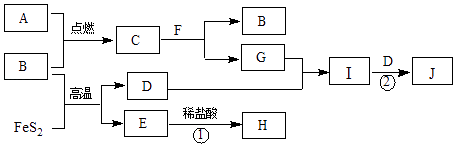
回答下列问题:
(1)C的化学式是 .
(2)气体D通入紫色石蕊溶液的现象是 .
(3)写出反应①的离子方程式 .
(4)写出反应②的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脂肪烃CnHm分子中,碳碳原子间共用电子对数为(用含n、m的式子表示).若某脂肪烃分子中,碳碳原子间共有电子对数为28,且分子内含一个双键和一个叁键,则它的分子式为 . 若将Cn看做烃分子中的氢原子完全失去后的产物,则C60中碳碳原子间共用电对数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2 , 也可被还原为氢气.为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为101 kPa,温度为0℃).
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是 .
A.200mL
B.400mL
C.500mL
(2)若1.30g锌粒完全溶解,测得盛氢氧化钠溶液的洗气瓶增重1.28g,则圆底烧瓶中发生反应的化学方程式为: .
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g量气管中收集到VmL气体,其依据得失电子守恒的原理,可得出a、b、V之间的关系为:是 .
(4)若在烧瓶中投入d g锌,再加入VL c mol/L 浓硫酸,充分反应后锌有剩余,测得盛氢氧化钠溶液的洗气瓶增重m g,则整个实验过程产生的混和气体中H2和SO2物质的量之比 ![]() =(用含字母的代数式表示).若撤走盛有无水氯化钙的U型管,
=(用含字母的代数式表示).若撤走盛有无水氯化钙的U型管, ![]() 的比值将(填偏大、偏小或无影响)
的比值将(填偏大、偏小或无影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
A.将1 mol BaCl2 溶于水所形成的溶液中含NA个氯离子
B.2克氢气所含原子数约为6.02×1023
C.标准状况下,22.4 L SO2所含的分子数为NA
D.常温常压下,22.4 L O2和O3的混合气体所含分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能.
A.①②③④
B.⑤⑥⑦⑧
C.①③⑤⑥⑦⑧
D.③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+ , 发现和探究过程如下.
向硝酸酸化的0.05molL﹣1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
(1)检验产物
①取少量黑色固体,洗涤后,(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有 .
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+ , 乙认为铁粉过量时不可能有Fe3+ , 乙依据的原理是(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3min时量小;溶液红色较3min时加深 |
ⅲ | 120 | 产生白色沉淀;较30min时量小;溶液红色较3 0min时变浅 |
(资料:Ag+与SCN﹣生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2 , 由于(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3﹣具有氧化性,可产生Fe3+;
假设d:根据现象,判断溶液中存在Ag+ , 可产生Fe3+ .
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
实验Ⅱ:装置如图.其中甲溶液是 , 操作现象是 . 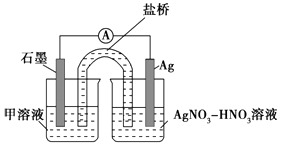
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )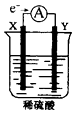
A.X极上发生的是还原反应
B.若两电极分别为Fe和碳棒,则Y为Fe
C.若反应进行一段时间后,产生2克H2时转移了1mol电子
D.溶液中的SO42-向X极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是( )
A.98%的H2SO4物质的量浓度为18.4mol/L ,则49%的H2SO4物质的量浓度为9.2mol/L
B.当2L水吸收44.8L氨气(标况)时所得氨水的浓度不是1molL-1 , 只有当44.8L(标况)氨气溶于水制得2L氨水时,其浓度才是1molL-1
C.只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D.50mL 1mol/L的AlCl3溶液中的Cl—浓度与50ml 3mol/L的BaCl2溶液Cl—浓度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com