
下列说法错误的是()
A. 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性
B. 等物质的量浓度的醋酸与醋酸钠溶液中水电离产生的c(OH﹣).前者小于后者
C. 沉淀溶解达到平衡时,溶液中溶质的离子浓度不一定相等,但保持不变
D. 水的离子积只与温度有关,向水中加入酸、碱或盐一定会影响水的电离平衡
考点: 氨的化学性质;弱电解质在水溶液中的电离平衡;水的电离;难溶电解质的溶解平衡及沉淀转化的本质.
专题: 电离平衡与溶液的pH专题.
分析: A.能使湿润红色石蕊试纸变蓝色的气体是碱性气体;
B.酸抑制水电离,含有弱根离子的盐促进水电离;
C.沉淀溶解达到平衡时,溶液中各种离子达到饱和状态;
D.水的离子积常数只与温度有关,但酸抑制水电离,含有弱根离子的盐促进水电离.
解答: 解:A.能使湿润红色石蕊试纸变蓝色的气体是碱性气体,碱性气体溶于水生成碱,故A正确;
B.酸抑制水电离,含有弱根离子的盐促进水电离,醋酸抑制水电离,醋酸钠促进水电离,所以两种溶液中产生的氢氧根离子浓度前者小于后者,故B正确;
C.沉淀溶解达到平衡时,溶液中各种离子达到饱和状态,溶液中溶质的离子浓度不一定相等,只要外界条件不变,则溶液中各种离子浓度不变,故C正确;
D.水的离子积常数只与温度有关,但酸抑制水电离,含有弱根离子的盐促进水电离,所以向水中加入酸、碱或盐可能会影响水的电离平衡,温度不变,但溶液中水的离子积常数不变,故D错误;
故选D.
点评: 本题考查较综合,涉及气体的检验、影响水电离平衡的因素、难溶物的溶解平衡等知识点,易错选项是D,注意水的离子积常数只与温度有关,但不是说只有温度才改变水的电离平衡,为易错点.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
关于工业生产的叙述,错误的是 ( )。
A.制普通玻璃的主要原料是纯碱、石灰石、石英
B.氨是制作氮肥、硝酸、铵盐的重要原料
C.将二氧化硫催化氧化生成三氧化硫后,在吸收塔内用水吸收制得浓硫酸
D.制造普通水泥的主要原料是黏土、石灰石
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,反应X(g)+3Y(g)⇌2Z(g)达到化学平衡状态的标志是( )
|
| A. | X、Y、Z的分子数比为1:3:2 |
|
| B. | 单位时间生成amolX,同时生成3a molY |
|
| C. | X、Y、Z的浓度相等 |
|
| D. | 3v正(X)=v逆(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:
某化合物有碳、氢、氧三种元素组成,其红外光谱图有C﹣H键、O﹣H键、C﹣O键的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式是( )
|
| A. | CH3CH2OCH3 | B. | CH3CH2CH(OH)CH3 |
|
| C. | CH3CH2CH2OH | D. | CH3CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)盖斯是热化学的奠基人,于1840年提出盖斯定律,利用这一定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应.
已知:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ•mol﹣1,
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=﹣534kJ•mol﹣1.
请写出气态肼与NO2气体完全反应生成氮气和水蒸气的热化学方程式: .
(2)已知:N≡N的键能是946kJ•mol﹣1,H﹣H的键能为436kJ•mol﹣1,N﹣H的键能为393kJ•mol﹣1,计算合成氨反应生成1molNH3的△H= kJ•mol﹣1.
(3)现有25℃、pH=13的Ba(OH)2溶液,
①该Ba(OH)2溶液的物质的量浓度为
②加水稀释100倍,所得溶液中由水电离出c(OH﹣)=
③与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11,该盐酸溶液的pH= .
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO﹣)(填“>”或“=”或“<”).
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO﹣).
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组为研究电化学原理,设计如图装置.下列叙述错误的是()
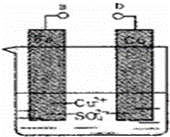
A. a和b不连接时,铁片质量会增加
B. a和b用导线连接时,正极发生的电极反应为:Cu2++2e﹣═Cu
C. 无论a和b是否连接,铁片均被腐蚀
D. a和b分别连接电源正、负极时,Fe电极发生的电极反应为:4OH﹣﹣4e﹣═2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下氨气和氧化铜可以发生如下反应:2NH3+3CuO 3Cu+N2+3H2O,下列对此反应的分析中合理的是()
3Cu+N2+3H2O,下列对此反应的分析中合理的是()
A. 该反应属于置换反应
B. CuO是氧化剂
C. 反应体现了金属铜的还原性
D. 每生成1molH2O就伴随着1mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
柠橡稀是一种食用香料,其结构为; 有关柠檬烯的分析正确的是()
有关柠檬烯的分析正确的是()
A. 柠檬烯的一氯代物有9种
B. 柠檬烯和丁基苯( )互为同分异构体
)互为同分异构体
C. 柠檬烯的分子中所有的碳原子可能在同一个平面上
D. 一定条件下,柠檬烯可以发生加成、取代、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
有关合金的性质叙述不正确的是 ( )。
A.合金的熔点比它的各成分金属的熔点低
B.合金一定是金属熔合而成的
C.合金的硬度和强度一般比纯金属高
D.硬铝、黄铜、钢均为合金
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com