
����Ŀ����ҵ�����õ������ (��Ҫ����Fe2O3��CuO��Cr2O3��������������������ͭ���Ƚ����������������£�
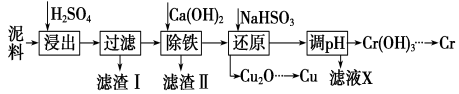
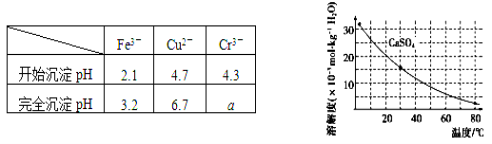
��֪�������ʳ�����pH��CaSO4���ܽ���������£�
��1���ڽ��������г�������Fe2(SO4)3��Cr2(SO4)3�⣬��Ҫ����__________________��
��2���ڳ��������У���Ҫ��ȥFe3����CaSO4���������ز�����
������ʯ�������pH��Լ________������Fe3���Ѿ������IJ�����_________________��
������Һ���ȵ�80����______________________��
��3��д����ԭ�����м���NaHSO3����Cu2O���巴Ӧ�����ӷ���ʽ�� ���˲����м���NaHSO3�õ�Cu2O�IJ���Ϊ95%����NaHSO3�����������˷��Լ��⣬������ֵ�������_______��
��4��������Ũ��С�ڻ����1��10-5mol��L-1ʱ����Ϊ������ȫ����ҪʹCr3����ȫ������Ҫ���� c(OH��)��______��[��֪��Ksp[Cr(OH)3]��6.3��10��31��![]() ��4.0]��
��4.0]��
���𰸡���1��CuSO4 ��2����3.2 ȡ������Һ����KSCN��Һ��������죬��˵��Fe3���ѳ� �����ȹ���
��3��2H2O��HSO3����2Cu2����Cu2O����SO42����5H�� ����SO2����Ⱦ���� ��4��4.0��10-9mol��L-1
��������
�����������1�����������м������ᣬ��������CuO��Cr2O3�������ᷴӦ����������������ͭ������������������������ʣ�����ҺI������������Ҫ��Fe2(SO4)3��Cr2(SO4)3��CuSO4 ��
��2�������������Ϣ�������ṩ�����ݣ��ڢڲ������У�����Ca(OH)2������Һ��pHĿ����ʹFe3���γɳ���������pHֵ�ķ�ΧΪ3.2��pH��4.3�������������Ѿ������IJ�����ȡ������Һ����KSCN��Һ��������죬��˵��Fe3���ѳ���������������ܽ�����¶ȵ���������������˽���Һ���ȵ�80����������ˡ�
��3�����������Ϣ��������ͭ���������Һ�м���NaHSO3������ש��ɫ����˵��ͭԪ�صĻ��ϼ��ɣ�2�۵õ������ɣ�1�۵�Cu2O������Ԫ�ر���ʧ���ӣ����ɣ�6�۵�SO42 ��������������ɫ�̼�����ζ�����壬˵��HSO3�� ��H����Ӧ������SO2 �������NaHSO3����Cu2O���巴Ӧ�����ӷ���ʽΪ2H2O��HSO3�� �� 2Cu2����Cu2O����SO42 ����5H������NaHSO3�����������˷��Լ��⣬������ֵ������Dz���SO2����Ⱦ������
��4��������Ũ�ȡ�1��10��5mol/Lʱ��������Ϊ���ӳ�����ȫ������c(Cr3��)��1��10��5mol/L��c(Cr3��)��c(OH��)3��Ksp[(Cr(OH)3]��6.3��10��31�����c(OH��)��4.0��10��9mol/L��


 �¿α�������������ҵ�������γ�����ϵ�д�
�¿α�������������ҵ�������γ�����ϵ�д� ����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ�Cѡ��5���л���ѧ������
�л���G��ij������ҩ����м��壬��ϳ�·�����£�

��֪��
�ش��������⣺
��1��д����Ӧ������Ҫ���Լ� ����Ӧ�ٵķ�Ӧ������ ��
��2���л���B�����������ŵ������� ��
��3��д���л���X�Ľṹ��ʽ ��
��4��д����E��F�Ļ�ѧ����ʽ ��
��5��д������ͬʱ��������������D��ͬ���칹��Ľṹ��ʽ ��
���ܷ���������Ӧ�� ���ܷ���ˮ�ⷴӦ
��6����1-����Ϊԭ�Ͽɺϳɱ�����������ƺϳ�·�ߣ����Լ����ܼ���ѡ����
��֪��ϩ���ϵ���������500������������ȡ����Ӧ��
ע���ϳ�·�ߵ���д��ʽ��������ʾ������ͼ��
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ա���ȩΪԭ���Ʊ����屽��ȩ(ʵ��װ�ü�ͼ��������ʵķе������)����ʵ�鲽��Ϊ��
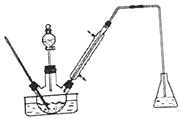
����1:������ƿ�е�һ����ȵ���ˮAlCl3�� 20mLl�� 2 -���������20mL����ȩ��ֻ�Ϻ�.������60���������μӾ�H2SO4�������Һ��20mL�����·�Ӧһ��ʱ�䣬��ȴ��
����2:����Ӧ����ﻺ������һ������ϡ�����У�__________��
����3:�л�����10%NaHCO3��Һϴ�ӡ���ϴ�ӵ��л������������ˮMgSO4���壬����һ��ʱ�����ˡ�
����4:��ѹ�����л��࣬�ռ���Ӧ��֡�
��1��ʵ��װ���������ܵ���Ҫ������__________����ƿ�е���ҺӦΪ__________��
��2������1������������У�AlCl3�Ǵ��������Ʋ�1�� 2-�������������__________��
��3����ͬѧ���齫װ�����¶ȼƻ��ɽ���������ô�¶ȼ�Ӧ�Ƶ�ʲô�ط�__________��
��4������2����������__________��
��5������3����10%��NaHCO3��Һϴ�ӵľ��������__________��������ˮMgSO4�����������__________��
��6������4�в��ü�ѹ����������Ϊ�˷�ֹ__________��
��7������ռ������屽��ȩ10mL�����ʵ��IJ���Ϊ__________��
����������ʵķе�(101kPa)

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����16�֣�����β���е���Ҫ��Ⱦ����NO��CO��Ϊ���������Ⱦ���������ͨ�����·�Ӧ����������β����
��1��2NO��g��+2CO��g��2CO2��g��+N2��g����H=��746.5KJ/mol ������Ϊʹ�ô�����
��֪��2C ��s��+O2��g��2CO��g����H=��221.0KJ/mol
C ��s��+O2��g��CO2��g����H=��393.5KJ/mol
��N2��g��+O2��g��=2NO��g����H= kJmol��1��
��2��T���£���һ�ݻ�������ܱ������У�ͨ��һ������NO��CO�������崫������ò�ͬʱ��NO��CO��Ũ�����±�
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 | |||||||
C��NO��10��4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 | |||||||
C��CO��10��3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 | |||||||
��C2��������ֵΪ ������ĸ��ţ���
A��4.20 B��4.00 C��2.95 D��2.80
��3������ͬ���ʵ�����H2O��g����CO��g���ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У����з�Ӧ��H2O��g��+CO��g��CO2��g��+H2��g�����õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
��a=2��b=1����c= ����ƽ��ʱʵ����ii��H2O��g����ʵ����iii��CO��ת���ʵĹ�ϵΪ��ii��H2O�� ��iii��CO�������������������=������
��4���������������Դ����CO�ڴ����������Ʊ������ѵķ�Ӧԭ��Ϊ��2CO��g��+4H2��g��CH3OCH3��g��+H2O��g������֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�![]() �ı仯������ͼ1��ʾ��
�ı仯������ͼ1��ʾ��
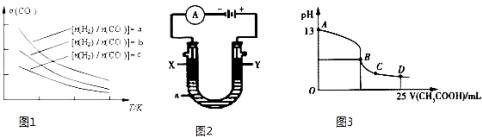
��a��b��c���Ӵ�С��˳������Ϊ ��
������ͼ������жϸ÷�ӦΪ���ȷ�Ӧ�������� ��
��5��CO�����Ĵ������ɲⶨ����β���Ƿ�����ŷű����÷����ǵĹ���ԭ��������ȼ�ϵ�أ����е�����������ƣ�Y2O3��������ﯣ�ZrO2�����壬�ܴ���O2����
�����ĵ缫��ӦʽΪ ��
�����������Ϊ��Դ��ͨ���������ӳ�ͼ2����X��YΪʯī��aΪ2L 0.1mol/L KCl��Һ���һ��ʱ���ȡ25mL �����������Һ���μ�0.4mol/L����õ�ͼ3���ߣ�������������ʧ����������ˮ����Һ����仯���Բ��ƣ�������ͼ�����㣬������������ ����һ����̼������Ϊ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʾ��Ԫ�����ڱ�ʾ��ͼ��һ���֣����ݱ���10��Ԫ�أ���Ԫ�ط��Ż�ѧʽ��ա�
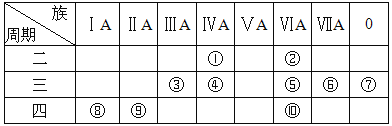
��1��������Ԫ����,��������ǿ���� (��Ԫ�ط���)����ѧ��������õ��� (��Ԫ�ط���)��
��2��������Ԫ����,����������Ӧ��ˮ��������Ե�Ԫ���� (��Ԫ�ط���)����ˮ������NaOH��Һ��Ӧ�����ӷ���ʽΪ ��
��3��������Ԫ����,����������Ӧ��ˮ�����������ǿ���� (�ѧʽ)��������ǿ���� (�ѧʽ)��
��4�������������������γɵļ����ӵİ뾶�ɴ�С��˳���� ���������ӷ��ţ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��W��V��U�Ƕ����ڵ�����Ԫ�أ�ԭ��������������X��Vͬ���壬����W�����γ�A2B��A2B2�ͻ����Z��W�ĵ��ʳ����¾�Ϊ��ɫ���壻Y��Uͬ������Yԭ�ӵ�L���������K���������2�����Իش��������⣺
��1��д��UԪ�������ڱ��е�λ�� ��V���ӽṹʾ��ͼΪ ��YW2�ĵ���ʽ ��
��2��Y��U�ļ��⻯����ȶ���������ǿ��˳���� ��
��3��V������������ˮ���ﲻ��ʹ�ò������Լ�ƿʢ�ŵ�ԭ���� �����û�ѧ����ʽ��ʾ��
��4����X��Z��ɵ�һ�ֻ����ﻯѧʽΪZX5�����ԭ�Ӿ��ﵽͬ����ϡ������ԭ�ӵ��ȶ��ṹ������������ (��������������������)�����
��5��X��Y��Z��W����Ԫ�أ���˳�����ԭ�Ӹ�����Ϊ5��1��1��3�Ļ�����û������ϡ��Һ����������������Һ�ڼ��������·�Ӧ�����ӷ���ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ�����ݻ�Ϊ2L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ����ͼ�����ݷ�����
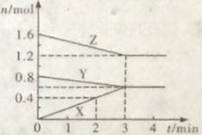
��1���÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
��2����Ӧ��ʼ��2minĩ�� X�ķ�Ӧ����Ϊ ��
��3����Ҫ�ӿ�÷�Ӧ�Ļ�ѧ��Ӧ���ʿ��Բ�ȡ�Ĵ�ʩ�У���������Ũ�ȡ���ѹ�� ��ʹ���������ȡ�
��4����Ӧ�ﵽƽ��״̬����ʼʱ��Ϊ min,ƽ��ʱZ��ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ҫ�ɷ�ΪFeTiO3(�ɱ�ʾΪFeO��TiO2)����������MgO��CaO��SiO2�����ʡ������������Ʊ�����ӵ�ص缫����(�����Li4Ti5O12�����������LiFePO4)�Ĺ�����������ͼ��ʾ��
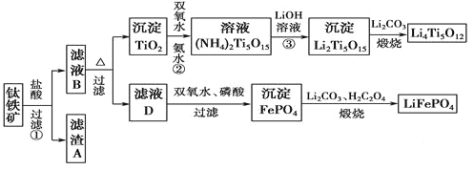
��֪��FeTiO3�����ᷴӦ�����ӷ���ʽΪ��FeTiO3+4H++4Cl��===Fe2++TiOCl42��+2H2O��
��1��������FeTiO3����Ԫ�صĻ��ϼ��� ��
��2������A�ijɷ��� ��
��3����ҺB��TiOCl42��ת������TiO2�����ӷ���ʽΪ ��
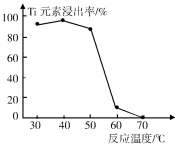
��4����Ӧ���й���TiO2ת����(NH4)2Ti5O15��Һʱ��TiԪ�صĽ������뷴Ӧ�¶ȵĹ�ϵ��ͼ��ʾ����Ӧ�¶ȹ���ʱ��TiԪ�ؽ������½���ԭ���� ��
��5��д������ҺD����FePO4�����ӷ���ʽ ��
��6������ҺD�Ʊ�LiFePO4�Ĺ����У�����17%˫��ˮ��H2C2O4���������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ�����²�����![]() �Ʊ�
�Ʊ�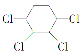
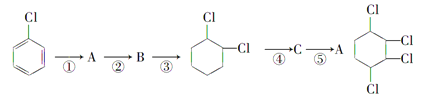
��1��д��A��B�Ľṹ��ʽ��A��______________ B��______________��
��2��������������дÿ����Ӧ�����ķ�Ӧ���ͣ�a.ȡ����Ӧ��b.�ӳɷ�Ӧ��c.��ȥ��Ӧ��ֻ����ĸ���ţ��� ��
��3��д���ܵķ�Ӧ����ʽ��
��4��д��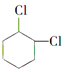 �ĺ�����Ԫ̼����ͬ���칹�壺
�ĺ�����Ԫ̼����ͬ���칹�壺
��5��д�����Ʊ������ĺϳ�·��ͼ���л��ϳ�·��ͼʾ�����£�
![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com