
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与3.36LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol·L-1NaOH溶液至 Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60mLB.120mLC.240mLD.360mL
【答案】B
【解析】
Cu失去的电子全部转移给HNO3,生成了氮氧化物,而这些氮氧化物又全部将所得电子转移给了O2,生成了HNO3,相当于Cu失去的电子全部转移给了O2,故可以通过O2的量来计算参加反应的Cu的量,也可以计算出生成的Cu2+的量,从而计算得NaOH的体积。
Cu失去的电子全部转移给HNO3,生成了氮氧化物,而这些氮氧化物又全部将所得电子转移给了O2,生成了HNO3,相当于Cu失去的电子全部转移给了O2;n(O2)=![]() =0.15mol,则转移电子0.6mol,故可以有0.3mol Cu参加反应,即生成0.3mol Cu2+,则需要0.6mol NaOH形成沉淀,故V(NaOH)=
=0.15mol,则转移电子0.6mol,故可以有0.3mol Cu参加反应,即生成0.3mol Cu2+,则需要0.6mol NaOH形成沉淀,故V(NaOH)=![]() =0.12L=120mL,故选B。
=0.12L=120mL,故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工原料,我国主要采用接触法生产硫酸,主要过程如下:
FeS2 ![]() SO2
SO2 ![]() SO3
SO3 ![]() H2SO4
H2SO4
回答下列问题:
(1)基态V原子的电子排布式为________,基态Fe原子核外未成对电子数为______。
(2)组成H2SO4的元素中,电负性由大到小的顺序是________,SO2分子的VSEPR模型为________。
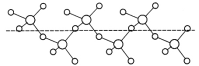
(3)固态SO3能以无限长链形式存在(如图所示)。其中S原子的杂化形式为______。长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是________(填“桥氧”或“端基氧”),原因是______________。
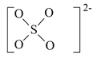
(4)绿矾是一种重要的硫酸盐,其组成可写成[Fe(H2O)6]2+[SO4(H2O)]2-,水合阴离子中H2O通过氢键与SO42-中的O原子相联结,按图示画出含氢键的水合阴离子:______________。
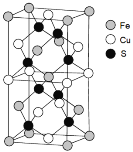
(5)一种含Fe、Cu、S三种元素的矿物晶胞如图所示,属于四方晶系(晶胞底面为正方形)。S2-的配位数为______。若晶胞的底面边长为a pm,高为b pm,晶体密度为ρ g/cm3,则阿伏加德罗常数可表示为____________(写出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ/mol
①N2(g)+2O2(g)=2NO2(g) △H1=+133kJ/mol
②H2O(g)=H2O(l) △H2=-44 kJ/mol
写出在催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为___。
Ⅱ.脱碳:
(1)向2L恒容密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l) +H2O(l)。
CH3OH(l) +H2O(l)。
下列叙述能说明此反应达到平衡状态的是___。
A.混合气体的平均式量保持不变 B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等 D.混合气体的密度保持不变
E.1 molCO2生成的同时有3molH—H键断裂
(2)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应CO(g) +2H2(g)![]() CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图所示。
CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图所示。
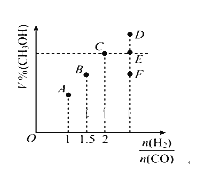
①当起始n(H2)/n(CO)=2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率v(H2)=____。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____(选填“增大”、“减小”或“不变”);
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___点(选填“D”、“E”或“F”)。
(3)已知反应A(g)+B(g)![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.20molA和0.20molB,10s时达到平衡。
C(g)+D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.20molA和0.20molB,10s时达到平衡。
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
该反应是____反应(填“吸热反应”或“放热反应”);反应初始至平,A的平均反应速率v(A)=_____。达到平衡后,B的转化率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空
(1)![]() 的系统命名____。
的系统命名____。
(2)2,5-二甲基-2,4-己二烯的结构简式:___。
(3)![]() 的键线式:____。
的键线式:____。
(4)C4H10O的同分异构体中,属于醇类且含有“手性碳原子”的结构简式为____。
(5)有机物二苯甲烷![]() 中,该分子中有__种不同化学环境的H原子。
中,该分子中有__种不同化学环境的H原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据反应![]() ,回答下列问题:
,回答下列问题:
①用双线桥法标出该反应中电子转移的方向和数目:______。
②该反应中______元素被还原,______元素被氧化。
③在该反应中,若有![]() 电子发生转移,在标准状况下,可生成
电子发生转移,在标准状况下,可生成![]() 的体积为_____L。
的体积为_____L。
(2)配平化学方程式且回答下列问题:
①______ ![]() ______
______![]() ___
___![]() _____
_____![]() ___ Cl2 ___H2O
___ Cl2 ___H2O
②若生成![]() ,则被氧化的HCl是_________mol,
,则被氧化的HCl是_________mol,
(3)已知反应:2H2S+H2SO3=2H2O +3S,若氧化产物比还原产物多![]() ,则同时会生成水的质量为 ______ g。
,则同时会生成水的质量为 ______ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇是一种抗肿瘤的药物,合成它的一种路线如图:
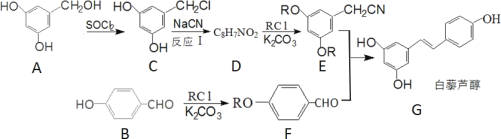
回答下列问题:
(1)B 的化学名称是_______;G 中含有的官能团名称是_________。
(2)反应I的反应类型为____________。
(3)D 的结构简式是______________。
(4)B的芳香类同分异构体中可以发生水解的结构简式为_____________;该有机物在 NaOH溶液作用下完全水解的化学反应方程式为______________。
(5)据已有知识并结合相关信息,写出以 ![]() 和 CH3OH 为原料制备
和 CH3OH 为原料制备 ![]() 的合成路线流程图______________(无机试剂任用)。 (已知 RCN
的合成路线流程图______________(无机试剂任用)。 (已知 RCN![]() RCOOH)合成路线流程图如下: (甲
RCOOH)合成路线流程图如下: (甲![]() 乙……
乙……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯是重要的有机合成原料,常用作高辛烷值汽油稳定剂。其实验室制备流程如下:
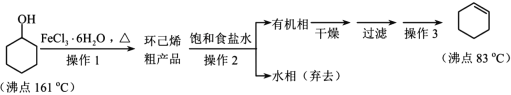
请回答下列问题:
(1)实验室用FeCl3 溶液制备 FeCl3·6H2O 的方法是__________。
(2)操作 1 的装置如图所示(加热和夹持装置已略去)。
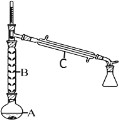
①仪器B的作用为_________。
②烧瓶A中进行的可逆反应化学方程式为_______
(3)浓硫酸也可作该反应的催化剂,选择 FeCl3·6H2O 而不用浓硫酸的原因为________(填选项)。
A.浓硫酸易使原料碳化并产生 SO2
B.FeCl3·6H2O 污染小、可循环使用,符合绿色化学理念
C.同等条件下,用 FeCl3·6H2O 比浓硫酸的平衡转化率高
(4)操作2用到的玻璃仪器是____________。
(5)环己烯含量的测定:在一定条件下,向 a g 环己烯样品中加入定量制得的b mol Br2, 与环己烯充分反应后,剩余的 Br2 与 足 量 KI 作用生成 I2 ,用 c molL-1 的 Na2S2O3标准溶液滴定,终点时消耗 Na2S2O3 标准溶液 v ml(以上数据均已扣除干扰因素)。测定过程中,发生的反应如下:
①![]() +Br2→
+Br2→![]()
② Br2+ KI=I2 + 2KBr
③ I2 + 2Na2S2O3=2 NaI+ Na2S4O6
滴定所用指示剂为_____________________ ;样品中环己烯的质量分数为_________________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题:
(Ⅰ)下列一组有水参与的反应:
①2Na + 2H2O = 2NaOH + H2↑ ②2Na2O2 + 2H2O = 4NaOH + O2↑
③Na2O + H2O =2NaOH ④2H2O![]() 2H2↑+ O2↑ ⑤2F2 + 2H2O = 4HF + O2
2H2↑+ O2↑ ⑤2F2 + 2H2O = 4HF + O2
(1)其中不属于氧化还原反应的是____________(填编号)
(2)在这些氧化还原反应中,水只作氧化剂的反应是___________(填编号);水只作还原
剂的反应是___________(填编号);水既作氧化剂,又作还原剂是_________(填编号);水既不作氧化剂,又不作还原剂是___________(填编号)。
(3)根据你的理解,氧化还原反应的特征是_____。
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?______(填“是”或“不是”),若是,这个反应的氧化剂是_________,氧化产物是________,被氧化的氮元素与被还原的氮元素的物质的量之比是______;如果3mol的NO2完全反应,应转移____________个电子。
(Ⅱ)现有以下物质:(填序号)
① 铜 ② CO2 ③ 水 ④ CaCO3固体 ⑤ 蔗糖
以上物质中能导电的是______________,以上物质中属于电解质的是____________,以上物质中属于非电解质的________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如下图所示,试回答:
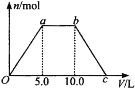
(1)a点之前的反应的离子方程式为________________。
(2)a点到b点之间的反应的离子方程式是________________、________________。
(3)c点二氧化碳体积是________L。
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com