
| A、盐酸和氢氧化钠溶液之间的中和反应 | ||||
B、CO2+C
| ||||
C、金属镁燃烧:2Mg+O2
| ||||
| D、生石灰溶于水:CaO+H2O=Ca(OH)2 |


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| 元素代号 | U | V | W | X | Y | Z |
| 原子半径/nm | 0.037 | 0.157 | 0.066 | 0.070 | 0.077 | 0.143 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 | +3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
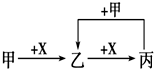 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图.则甲和X(要求甲和X能互换)不可能是[提示:Al3++3AlO2-+6H2O=4Al(OH)3↓]( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图.则甲和X(要求甲和X能互换)不可能是[提示:Al3++3AlO2-+6H2O=4Al(OH)3↓]( )| A、C和O2 |
| B、SO2和NaOH溶液 |
| C、Cl2和Fe |
| D、AlCl3溶液和NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、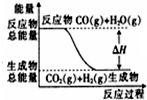 表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”中的△H>0 |
B、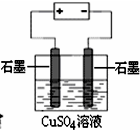 为电解硫酸铜溶液的装置,电解前后溶液的pH几乎不变 |
C、 实验装置可完成比较乙酸、碳酸、硅酸酸性强弱的实验 |
D、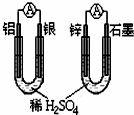 两个装置通过的电量相等时,消耗负极材料的物质的量也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大压强,使活化分子数目增加,化学反应速率一定增大 |
| B、活化分子间所发生的分子间碰撞均为有效碰撞 |
| C、升高温度,使活化分子百分数增加,化学反应速率一定增大 |
| D、加入反应物,使活化分子百分数增加,化学反应速率一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molN2所含分子数约为6.02×1023 |
| B、58.5g NaCl所含离子数约为6.02×1023 |
| C、标准状况下,22.4L H2所含原子数约为6.02×1023 |
| D、常温常压下,分子总数约为6.02×1023的SO2的质量是64 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com