
现有A、B、C、D、E五种短周期主族元素,其原子序数依次增大,它们之间关系如下:
Ⅰ.原子半径:A < C < B < E<D
Ⅱ.原子的核外电子层数:B = C = 2A
Ⅲ.B元素的主要化合价:最高正价 +最低负价 = 2
Ⅳ.C是周期表中非金属性最强的元素
V.原子的最外层电子数:B + D = 8
VI.E是同周期中半径最小的原子
请回答:
(1)实验室制取E的单质反应离子方程式为_____________________________________。
(2)只有A和B两种元素组成的属于离子晶体的化合物可能为 (用化学式表示)。
(3)由D元素形成的氢氧化物,与强碱溶液反应的离子方程式为 。
下列可作为比较D和Mg金属性强弱的方法是_______(填代号)。
a.测两种元素单质的硬度和熔、沸点 b. 比较最高价氧化物对应的水化物的碱性强弱
c.比较单质与同浓度盐酸反应的剧烈程度 d.. 比较两种元素在化合物中化合价的高低
(4)由B、C元素组成的化合物BC3,该化合物具有强氧化性,与水反应生成两种酸和一种无色气体,该气体常温下遇空气变红棕色,写出该化合物与水反应的化学方程式 ______________________ ______________ ________ 。
(5)由A、B和C三种元素组成的盐,常温下其水溶液显酸性,写出检验该盐中所含阳离子的离子方程式 ;
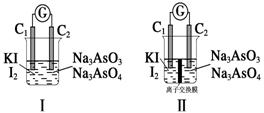 (6)下图Ⅰ、Ⅱ分别是甲、乙两组同学将与B元素同主族的砷元素的化合物按反应“AsO
(6)下图Ⅰ、Ⅱ分别是甲、乙两组同学将与B元素同主族的砷元素的化合物按反应“AsO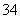 +2I-+2H+
+2I-+2H+ AsO
AsO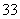 +I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸或40% NaOH溶液,电流表指针都不发生偏转;乙组经思考后先添加了一种离子交换膜,然后向图Ⅱ烧杯右侧中逐滴加入适量40%NaOH溶液,发现电流表指针发生偏转。
+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸或40% NaOH溶液,电流表指针都不发生偏转;乙组经思考后先添加了一种离子交换膜,然后向图Ⅱ烧杯右侧中逐滴加入适量40%NaOH溶液,发现电流表指针发生偏转。
① 甲组电流表指针都不发生偏转的原因是 。
② 乙组添加的是 (填“阴”或“阳”)离子交换膜。
科目:高中化学 来源: 题型:
有机物A、B、C、D、E、F、G相互关系如图所示。5.2 g F能与100 mL 1 mol·L-1的NaOH溶液恰好完全中和,0.1 mol F还能与足量金属钠反应,在标准状况下放出2.24 L H2。D的分子式为C3H3O2Na,E的分子中含有羧基。
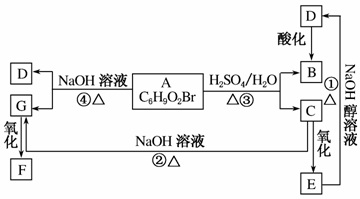
(1)写出下列物质的结构简式:G:________________;F:________________。
(2)化学反应类型:①________________;④________________。
(3)化学方程式:①__________________________;③__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)CaS(s)+4CO2(g)
ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)反应Ⅰ能够自发进行的反应条件是________。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量的浓度c(B),则反应Ⅱ的Kp=________(用表达式表示)。
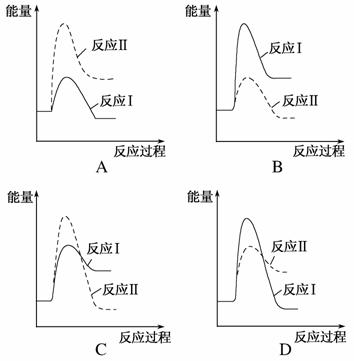
(3 )假设某温度下,反应Ⅰ的速率(v1)大于
)假设某温度下,反应Ⅰ的速率(v1)大于 反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是________。
反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是________。
(4)通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是____________________________________________________ ______________________________________________________________________________________
(5)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有________。
A.向该反应体系中投入石灰石
B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数
D.提高反应体系的温度
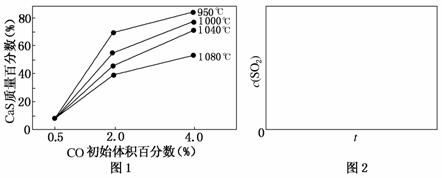
(6)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请在图2中画出反应体系中c(SO2)随时间t变化的总趋势图。
查看答案和解析>>
科目:高中化学 来源: 题型:
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示。下列分析错误的是( )
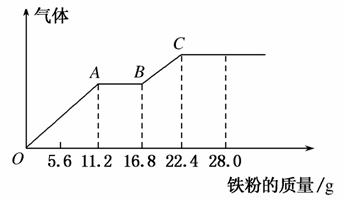
A.AB段的反应为:Fe+2Fe3+===3Fe2+
B.第二份溶液中最终溶质为FeSO4
C.混合酸中NO 物质的量为0.4 mol
物质的量为0.4 mol
D.混合酸中H2SO4浓度为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的是 ( )
A.惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L
B.标准状况下,4.0 g CH4中含有共价键的数目为NA
C.1 mol C12发生化学反应,转移的电子数必为2NA
D.在反应KIO3+6HI =KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式:
H2O(g)=H2(g) + 1/2O2(g) △H = +241.8kJ/mol
H2(g)+ 1/2O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是( )
A.吸热88kJ B. 吸热2.44KJ C.放热44kJ D. 吸热44KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列按纯净物、混合物、电解质和非电解质顺序排列的是 ( )
A.盐酸、空气、醋酸、干冰 B.冰醋酸、福尔马林、硫酸钠、乙醇
C.蛋白质、油脂、苛性钾、石灰石 D.胆矾、漂白粉、氯化钾、硫酸钡
查看答案和解析>>
科目:高中化学 来源: 题型:
现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的的转化率_________。
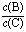 (4)若升高温度,则平衡时B、C的浓度之比 将______ ___。
(4)若升高温度,则平衡时B、C的浓度之比 将______ ___。
(5)若加入催化剂,平衡时气体混合物的总物质的量____ _____。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色______ _;而维持容器内压强不变,充入氖气时,混合物颜色____ ___(填“变深”“变浅”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
现取m g镁铝合金在一定浓度的稀硝酸中恰好完全溶解(硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中正确的有( )
①沉淀中OH-的质量为(n-m)g
②恰好溶解后溶液中的NO 的物质的量为
的物质的量为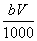 mol
mol
③反应过程中转移的电子为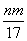 mol
mol
④标准状况下生成NO的体积为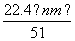 L
L
⑤与合金反应的硝酸的物质的量为 mol
mol
A.5项 B.4项 C.3项 D.2项
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com