
| A. | Al3+、K+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | B. | Na+、AlO${\;}_{2}^{-}$、HCO${\;}_{3}^{-}$、K+ | ||
| C. | ClO-、I-、NH${\;}_{4}^{+}$、Ba2+ | D. | Na+、SO${\;}_{4}^{2-}$、Mg2+、Cl- |
分析 A.浓度相同时四种离子不满足电荷守恒;
B.碳酸氢根离子的酸性大于氢氧化铝,偏铝酸根离子与碳酸氢根离子反应生成氢氧化铝沉淀;
C.次氯酸根离子具有强氧化性,能够氧化碘离子;
D.四种离子之间不反应,能够配制该溶液.
解答 解:A.物质的量浓度都为1mol/L时,K+、NO3-、HCO3-不满足电荷守恒,无法配制该溶液,故A错误;
B.AlO2-、HCO3-之间反应生成碳酸根离子和氢氧化铝沉淀,无法在同一溶液中大量共存,故B错误;
C.ClO-、I-之间发生氧化还原反应,在溶液中不能大量共存,无法配制该溶液,故C错误;
D.Na+、SO42-、Mg2+、Cl-之间不发生反应,浓度相等时满足电荷守恒,可以配制此溶液,故D正确;
故选D.
点评 本题考查离子共存的判断及应用,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件:“溶液中四种离子的浓度均为1mol/L”;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:实验题
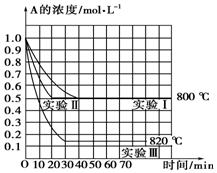 在一恒容密闭容器中发生某化学反应2A(g)?B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B、C的起始浓度都为0,反应物A的浓度(mol•L-1)随时间(min)的变化如图所示,请回答:
在一恒容密闭容器中发生某化学反应2A(g)?B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B、C的起始浓度都为0,反应物A的浓度(mol•L-1)随时间(min)的变化如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 少量的浓硫酸或浓NaOH沾到皮肤上,应用大量的水反复冲洗,再涂抹相应的药品 | |
| B. | 氢气还原氧化铜,一般先预热氧化铜,然后再通入氢气 | |
| C. | 浓硝酸需用细口棕色试剂瓶密封保存 | |
| D. | 实验室制备有毒气体应在通风橱中进行,且必须对尾气进行吸收或处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 2mol•L-1 KClO3溶液 | B. | 75mL 2mol•L-1CaCl2溶液 | ||
| C. | 150mL 2mol•L-1 KCl溶液 | D. | 75mL 1mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5KJ•mol-1(燃烧热) | |
| B. | C2H5OH+3O2═2CO2+3H2O△H=-1368.8KJ•mol-1(反应热) | |
| C. | 2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O (l)△H=-114.6KJ•mol-1(中和热) | |
| D. | 2H2O(g)═2H2(g)+O2(g)△H=+483.6KJ•mol-1(反应热) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com