
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备其单质 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
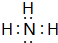 .
.分析 X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大.X元素是动植物生长不可缺少的元素,是蛋白质的重要成分,则X为N元素;Y元素在地壳中含量居第一位,则Y为O元素;Z是短周期中其原子半径最大的元素,则Z为Na;Q是生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备其单质,则Q为Al;M是海水中大量富集的元素之一,其最高正化合价与负价的代数和为6,则M为Cl.
解答 解:X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大.X元素是动植物生长不可缺少的元素,是蛋白质的重要成分,则X为N元素;Y元素在地壳中含量居第一位,则Y为O元素;Z是短周期中其原子半径最大的元素,则Z为Na;Q是生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备其单质,则Q为Al;M是海水中大量富集的元素之一,其最高正化合价与负价的代数和为6,则M为Cl.
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,该气态氢化物为NH3,电子式为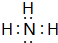 ,故答案为:
,故答案为: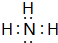 ;
;
(2)A.Rb、I同周期,核电荷数越大原子半径越小,故原子半径:Rb>I,故A正确;
B.RbI中含有离子键,故B错误;
C.非金属性Cl>I,则气态氢化物热稳定性:HCl>HI,故C正确;
D.Rb、Q、M的最高价氧化物对应的水化物分别为RbOH、高氯酸、氢氧化铝,RbOH碱性比NaOH的强,氢氧化铝能与RbOH、高氯酸反应,RbOH与高氯酸发生中和反应,故D正确,
故选:ACD;
(3)用Al和氮气的单质在800~1 000℃制得AlN,每生成1 mol AlN,吸收a kJ的热量,可得热化学方程式①:Al(s)+$\frac{1}{2}$N2(g)=AlN(s)△H=+a kJ/mol,
用氧化铝、焦炭和但在1 600~1 750℃生成Al,每消耗18 g碳生成1 mol AlN,吸收b kJ的热量,可得热化学方程式②:$\frac{1}{2}$Al2O3(s)+$\frac{1}{2}$N2(g)+$\frac{3}{2}$C(s)=AlN(s)+$\frac{3}{2}$CO(g)△H=+b kJ/mol,
根据盖斯定律,②×2-①×2可得:Al2O3(s)+3C(s)=2Al(s)+3CO(g)△H=(2b-2a) kJ/mol,
故答案为:Al2O3(s)+3C(s)=2Al(s)+3CO(g)△H=(2b-2a) kJ/mol;
(4)X、Y组成的一种无色气体遇空气变为红棕色,该气体为NO,标准状况下将40 LNO与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐,即生成NaNO2、NaNO3,该反应的离子方程式为:8NO+3O2+8OH-=2NO2-+6NO3-+4H2O,
故答案为:8NO+3O2+8OH-=2NO2-+6NO3-+4H2O.
点评 本题考查结构性质位置关系应用,涉及元素周期律、热化学方程式、氧化还原反应等,推断元素是题关键,是对学生综合能力考查,难度中等.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
 人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.| 金属元素 | Ni | Mn | Co | Fe | Cu | Zn |
| 浓度(g•L-1) | 45 | 15 | 7.5 | ≤0.1 | ≤0.05 | ≤0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水合肼(N2H4•H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:
水合肼(N2H4•H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果容器内压强不再改变,则证明该反应已达到平衡状态 | |
| B. | 寻找合适的催化剂是加快反应速率并提高CO2产率的有效措施 | |
| C. | 当反应达到平衡后,保持容器内体积不变,再向其中充入CO和H2O(g)各1 mol,达到新的平衡后CO2的产率会增大 | |
| D. | 如果在某温度下平衡常数为9.0,则平衡时CO转化率为75% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiC是一种新型无机非金属材料,任何条件下都不可能在空气中燃烧 | |
| B. | 制造粗硅时的反应:2SiO2+5C$\frac{\underline{\;高温\;}}{\;}$Si+SiC+4CO↑ | |
| C. | Si、SiO2能用NaOH溶液分离 | |
| D. | 纯净的SiO2只能用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
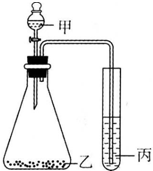
| A. | 甲-盐酸,乙-石灰石,丙-硅酸钠溶液,证明酸性:盐酸>H2CO3>H2SiO3 | |
| B. | 甲-盐酸,乙-亚硫酸钠,丙-溴水,证明还原性:HCI>SO2>HBr | |
| C. | 甲-浓盐酸,乙-高锰酸钾,丙-溴化钾,证明氧化性:KMnO4>Cl2>Br2 | |
| D. | 甲-氯化铵饱和溶液,乙-烧碱,丙-氯化铝,证明碱性:NaOH>NH3•H2O>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com