
以下有关原子结构及元素周期律的叙述正确的是( )
A.第ⅠA族元素铯的两种同位素137Cs比133Cs多4个质子
B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小
C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强
D.同主族元素从上到下,单质的熔点逐渐降低
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
下列各图为元素周期表的一部分(表中数字为原子序数),其中正确的是( )
A
| 2 | 3 | 4 |
| 11 | ||
| 19 |
B
| 2 | ||
| 10 | 11 | |
| 18 | 19 |
C
| 6 | ||
| 1 | 12 | 13 |
| 24 |
D
| 6 | 7 | |
| 14 | ||
| 31 | 32 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在碱性溶液中能大量共存且溶液为无色透明的离子组是
A.K+ 、MnO4-、Na+、Cl-
B. NH4+、Na+、Cl-、SO42-
C.Na+、H+、NO3-、SO42-
D. K+、Na+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z三种金属,把它们放在稀硫酸中,只有Y溶解放出气体。将Z放入X的盐溶液中,有X金属析出。已知X、Y、Z在化合物中均显+2价,则下列结论正确的是( )
A.金属性:Z>Y>X
B.还原性:X>Y>Z
C.氧化性:X2+>Z2+>Y2+
D.氧化性:X2+>Y2+>Z2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素最高价氧化物的水化物的化学式为HxROy,气态氢化物的化学式为HxR,已知1 mol HxROy比1 mol HxR质量多64 g,又知道1 mol HxROy中R的原子核外电子总数比氢原子和氧原子核外电子总数少16 mol,求R的原子序数。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据碘与氢气反应的热化学方程式:
(ⅰ)I2(g)+H2(g)2HI(g)
ΔH=-9.48 kJ·mol-1
(ⅱ)I2(s)+H2(g)2HI(g)
ΔH=+26.48 kJ·mol-1
下列判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(ⅰ)的产物比反应(ⅱ)的产物稳定
D.反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是( )
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )
A.CH3OH的标准燃烧热为-192.9 kJ·mol-1
B.反应①中的能量变化如图所示

C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+ O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
对于常温下pH为1的硝酸溶液,下列叙述正确的是( )
A.该溶液1 mL稀释至100 mL后,pH小于3
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
查看答案和解析>>
科目:高中化学 来源: 题型:
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1) COCl2的空间构型为 ;溴的价电子排布式为 。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列
式发生。
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是 。

(4)下列分子既不存在s-p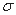 键,也不存在p-p
键,也不存在p-p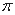 键的是 。
键的是 。
A. HCl B.HF C. SO2 D. SCl2
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为 ,写出CN-的等电子体的分子式 (写出1个)。
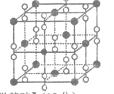
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为 。已知该氧化物的密度是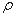 g·cm-3,则晶胞离得最近的两个钙离子间的距离为_ cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
g·cm-3,则晶胞离得最近的两个钙离子间的距离为_ cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com