
| ||
| A、上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B、上述反应中,CO为还原产物,具有还原性 |
| C、上述反应中,每生成1 mol AlN需转移3 mol电子 |
| D、AlN的摩尔质量为41 g |


科目:高中化学 来源: 题型:
A、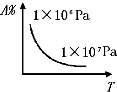 |
B、 |
C、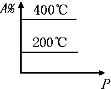 |
D、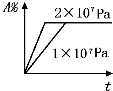 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质一定易溶于水,弱电解质都难溶于水 |
| B、NaHCO3的热稳定性和溶解度均大于Na2CO3 |
| C、过量的铜与浓硝酸反应有一氧化氮生成 |
| D、Fe与S混合加热生成FeS2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
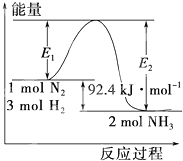 合成氨工业的核心反应是:N2(g)+3H2(g)
合成氨工业的核心反应是:N2(g)+3H2(g)| 催化剂 |
| 高温、高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 反应条件 | 反应速率 |
| (1) | 升高温度 | |
| (2) | 加入催化剂 | |
| (3) | 再充入a mol H2 | |
| (4) | 将容器容积扩大为原来2倍 | |
| (5) | 通入b mol Ne(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用10mL量筒量取8.10mL稀盐酸 |
| B、用pH计测得某溶液的pH为2.2 |
| C、用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 |
| D、可用25mL酸式滴定管量取20.00mL KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,在该反应中,当有3NA电子转移时,上述热化学反应方程式的焓变变为△H=46.2kJ/mol |
| B、1 L 0.1mol?L-1碳酸钠溶液的阴离子总数等于0.1 NA |
| C、室温下pH=13的NaOH溶液中含有的OH-0.1 NA |
| D、浓度分别为1 mol?L-1和 0.5mol?L-1的CH3COOH和CH3COONa 混合液共1L,含CH3COOH 和 CH3COO-共1.5 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com