
在下列条件下能否发生离子反应?对能发生的写出离子方程式,不能发生的说明理由
(1)CH3COONa溶液与HCl溶液混和_____________________________
(2)Ca(OH)2的澄清溶液与Na2SO4稀溶液混和____________________
(3)Ca(OH)2的澄悬浊液与Na2SO4浓溶液混和____________________
(4)CuCl2溶液与H2SO4溶液混和_________________________________
|
(1)CH3COO-+H+=CH3COOH (2)这里不能发生离子反应,理由是:在澄清的Ca(OH)2溶液、Na2SO4溶液中Ca(OH)2、Na2SO4都溶解且电离.假设Ca(OH)2与Na2SO4进行离子交换,则对应的“新物质”NaOH易溶易电离,CaSO4是微溶物质,它在稀溶液中也是易溶解且完全电离,假设不能成立,即没有离子反应发生. (3)Ca(OH)2+SO42-=CaSO4↓+2OH- (4)这里不能发生离子反应,理由是:氯化铜、硫酸均是易溶易电离的物质.假设氯化铜与硫酸发生离子交换,则对应的“新物质”是硫酸铜和盐酸,而硫酸铜和盐酸也是易溶易电离的物质,假设不能成立,即没有离子反应发生. |


科目:高中化学 来源:新课标 教材全解 高中化学 配人教版(必修1) 人教版 题型:022
在下列条件下能否发生离子反应?对能发生的写出离子方程式,不能发生的说明理由.
①CH3COONa溶液与HCl溶液混合.②向Ca(OH)2的澄清溶液中通入少量CO2.
③CuCl2溶液与H2SO4溶液混合.
查看答案和解析>>
科目:高中化学 来源: 题型:
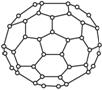
C60的结构
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C60分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系遵循欧拉定理:
顶点数+面数-棱边数=2。
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30。
请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是_________,理由是:_____________________________________________________________________。
(2)试估计C60跟F2在一定条件下能否发生反应生成C60F60(填“可能”或“不可能”)_______________________,理由:__________________________________。
(3)通过计算,确定C60分子所含单键数为 _________________。
(4)C70分子也已制得,它的分子结构模型可以与C60同样考虑而推知。通过计算确定C70分子中五边形和六边形的数目。C70分子中所含五边形数为___________,六边形数为__________。
查看答案和解析>>
科目:高中化学 来源:2012年鲁科版高中化学必修1 2.2电解质练习卷(解析版) 题型:填空题
在下列条件下能否发生离子反应?对能发生的写出离子方程式,不能发生的说明理由
(1)CH3COONa溶液与HCl溶液混和_________________________
(2)Ca(OH)2的澄清溶液与Na2SO4稀溶液混和____________________
(3)Ca(OH)2的澄悬浊液与Na2SO4浓溶液混和____________________
(4)CuCl2溶液与H2SO4溶液混和__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
1996年诺贝尔化学奖授予对发现 ![]() 有重大贡献的三位科学家.
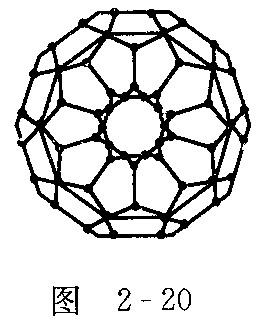
有重大贡献的三位科学家.![]() 分子是形如球状的多面体(如图2—20),该结构的建立基于以下考虑:
分子是形如球状的多面体(如图2—20),该结构的建立基于以下考虑:
①![]() 分子中每个碳原子只跟相邻的3个碳原子形成化学键;②
分子中每个碳原子只跟相邻的3个碳原子形成化学键;②![]() 分子只含有五边形和六边形;③多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数+面数-棱边数=2.据上所述,可推知
分子只含有五边形和六边形;③多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数+面数-棱边数=2.据上所述,可推知![]() 分子有12个五边形和20个六边形,
分子有12个五边形和20个六边形,![]() 分子所含的双键数为30.请回答下列问题:
分子所含的双键数为30.请回答下列问题:
(1)固体![]() 与金刚石相比较,熔点较高者应是___________,理由是_________.
与金刚石相比较,熔点较高者应是___________,理由是_________.
(2)试估计![]() 跟
跟![]() 在一定条件下能否发生反应生成
在一定条件下能否发生反应生成![]()
![]() (填“可能”或“不可能”)________.并简述其理由:_______.
(填“可能”或“不可能”)________.并简述其理由:_______.
(3)通过计算,确定![]() 分子所含单键数为________.
分子所含单键数为________.
(4)![]() 分子也已制得,它的分子结构模型可以与
分子也已制得,它的分子结构模型可以与![]() 同样考虑而推知,通过计算确定
同样考虑而推知,通过计算确定![]() 分子中五边形和六边形的数目.
分子中五边形和六边形的数目.![]() 分子中所含五边形数为__________,六边形数为________.
分子中所含五边形数为__________,六边形数为________.
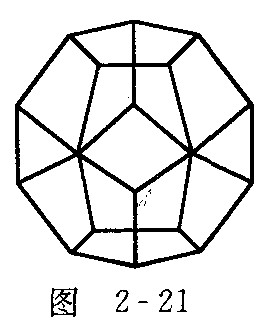
(5)德国和美国科学家首次制造出了由20个碳原子组成的空心笼状分子,如图2-21所示.这一成果刊登在2000年9月7日出版的英国《自然》杂志上.根据理论计算,包含20个碳原子、仅仅由正五边形构成的![]() 分子是富勒式结构分子中最小的一种.
分子是富勒式结构分子中最小的一种.![]() 中有__________个五边形;共有______条棱边.
中有__________个五边形;共有______条棱边.
(6)目前,科学家拟合成一种“二重构造”的球型分子,即把“足球型”的![]() 与“足球型”的
与“足球型”的![]() 的分子进行重新构造,并使硅原子与碳原子以共价键结合.请回答下列问题:
的分子进行重新构造,并使硅原子与碳原子以共价键结合.请回答下列问题:
①你认为![]() 与
与![]() 的分子应采取怎样的镶嵌_________,理由是________.
的分子应采取怎样的镶嵌_________,理由是________.
②“二重构造”后的晶体属于_________晶体,其熔点与![]() 、
、![]() 相比_______.
相比_______.
(7)最近有人用一种称为“超酸”的化合物![]() 和
和![]() 反应,使
反应,使![]() 获得一个质子,得到一种新型离子化合物
获得一个质子,得到一种新型离子化合物![]() .回答如下问题:
.回答如下问题:
①以上反应类型上可以跟中学化学课本中的一个化学反应相比拟,后者是_______________________.
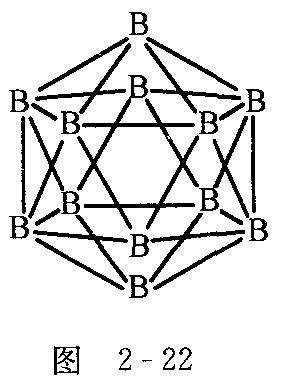
②上述阴离子![]() 的结构可以跟图2-22的硼二十面体相比拟,也是一个闭合的纳米笼,而且,
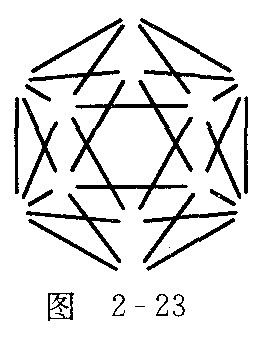
的结构可以跟图2-22的硼二十面体相比拟,也是一个闭合的纳米笼,而且,![]() 子有如下结构特征:它有一根轴穿过笼心,依据这根轴旋转360°/5的度数,不能察觉是否旋转过.请在图2-23中添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子.
子有如下结构特征:它有一根轴穿过笼心,依据这根轴旋转360°/5的度数,不能察觉是否旋转过.请在图2-23中添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com