
(15分)氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在。研究表明可采用双氧水氧化法处理电镀含氰废水。某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应)。
【查阅资料】
①Cu2+可作为双氧水氧化法废水处理过程中的催化剂;
②Cu2十在偏碱性条件下对双氧水分解影响较弱,可以忽略不计;
③[Fe(CN)6]3-较CN一难被双氧水氧化,pH越大,[Fe(CN)6]3-越稳定,越难被氧化。
[实脸设计]
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
实验编号 | 实验目的 | 初始pH | 废水样品体积mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积mL |
① | 为以下实验作参考 | 7 | 60 | 10 | 10 | 20 |
② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
③ | 10 |
【数据处理]
实验测得含氰废水中的总氰浓度(以CN一表示)随时间变化关系如下图所示。
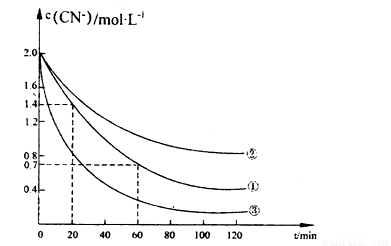
(2)实验①中20——60 min时间段反应速率v(CN-)= ____mol·L-1min-1。
【解释和给论]
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是______
(填一点即可)。
在偏碱性条件下,含氰废水中的CN一最终被双氧水氧化为HCO3- ,同时放出NH3,试写出该反应的离子方程式:
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实脸并验证上述结论,完成下表中内容。
(己知:废水中的CN一浓度可用离子色谱仪测定)
实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源:2014-2015甘肃省天水市高二下学期第一次月考化学试卷(解析版) 题型:填空题
有机物X(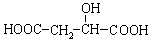 )广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多。
)广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多。
(1)有机物中X中含有的官能团名称是 ;在一定条件下有机物X可发生化学反应的类型有 (填序号);
A.水解反应
B.取代反应
C.加成反应
D.酯化反应
E.加聚反应
F.中和反应
(2)下列物质与X互为同分异构体的是 (填序号)

查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市秦安县高三第一次模拟考试化学试卷(解析版) 题型:选择题
肼(N2H4)又称联氨,可用如下方法制备:CO(NH2)2 + ClO- + OH- — N2H4 + Cl- + CO32- + H2O [CO(NH2)2中N为-3价,方程式未配平],下列说法不正确的是
A.N2H4是氧化产物
B.N2H4中存在极性键和非极性键
C.配平后,OH-的化学计量数为2
D.生成3.2 g N2H4转移0.1 mol电子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省六校联盟高三第三次联考理科综合化学试卷(解析版) 题型:实验题
(16分)草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一)探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:
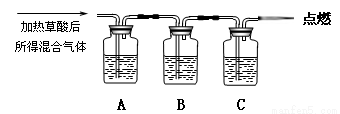
A、乙醇 B、 C、NaOH溶液。
(1)B中盛装的试剂 (填化学式)
(2)A中加入乙醇的目的是 。
(二)探究草酸的酸性
将0.01mol草酸晶体(H2C2O4·2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是 (用离子方程式表示)。
(三)用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理: MnO4- + H2C2O4 + = Mn2+ + CO2↑+ H2O
(1)配平上述离子方程式。
(2)滴定时KMnO4溶液应盛装于 (填 “酸式”或“碱式”)滴定管中。
Ⅱ、探究影响化学反应速率的因素
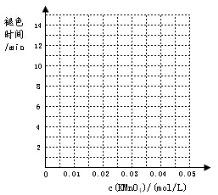
实验组别 | c(H2C2O4) /(mol/L) | V(H2C2O4) /ml | c(KMnO4) /(mol/L) | V(KMnO4) /ml | c(H2SO4) /(mol/L) | 褪色所需时间 | 实验 目的 |
1 | 0.2 | 2 | 0.0025 | 4 | 0.12 | 6'55'' | (a) |
0.2 | 2 | 0.005 | 4 | 0.12 | 5'17'' | ||
0.2 | 2 | 0.01 | 4 | 0.12 | 3'20'' | ||
0.2 | 2 | 0.02 | 4 | 0.12 | 9'05'' | ||
0.2 | 2 | 0.03 | 4 | 0.12 | 11'33'' | ||
0.2 | 2 | 0.04 | 4 | 0.12 | 14'20'' |
下表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
请回答:
(1)实验目的(a)是 ;
(2)根据表中数据在坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图像;
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省六校联盟高三第三次联考理科综合化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3
B.向煮沸的1 mol·L-1 NaOH溶液中滴加FeCl3饱和溶液可制备Fe(OH)3胶体
C.等体积pH=12的氨水和pH=12的NaOH溶液可中和含等物质的量HCl的盐酸
D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用酸去除
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省皖北协作区高三3月联考理综化学试卷(解析版) 题型:选择题
类推是学习和研究化学的重要思维方法。下列有关类推结论正确的是
选项 | 化学事实 | 类推结论 |
A | 铜丝在氧气中加热反应生成CuO | 铜丝在硫蒸汽中加热反应生成CuS |
B | 常温下,pH=2的稀盐酸加水稀释至100倍后溶液的pH变为4 | 常温下,pH=2的醋酸溶液加水稀释至100倍后溶液的pH变为4 |
C | 同一周期从左到右,主族元素的非金属性逐渐增强 | 同一周期从左到右,主族元素的电负性逐渐增大 |
D | 除去Na2CO3粉末中混有少量的NaHCO3,可采用加热的方法 | 除去碘粉中混有少量的NH4Cl,可采用充分加热的方法 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省合肥市高三第二次教学质量检测理综化学试卷(解析版) 题型:实验题
(13分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下:
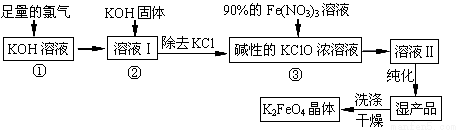
回答下列问题:
(1)反应①应在温度较低时进行,这是由于Cl2与KOH溶液在温度较高时反应生成KClO3,写出加热时该反应的化学方程式 。
(2)在溶液I中加入KOH固体的目的是 (填字母)。
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,同时得到副产品 (写化学式);判断K2FeO4晶体已经洗涤干净的方法是
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,请写出该反应的离子方程式:
(5)若消耗90%的硝酸铁溶液268.9g,则理论上可制得K2FeO4晶体 g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省上饶市高三上学期第一次联考化学试卷(解析版) 题型:选择题
已知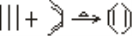 ,如果要合成
,如果要合成 所用的原始材料可以是
所用的原始材料可以是
A.2—甲基—1、3—丁二烯和2—丁炔
B.2、3—二甲基—1、3—戊二烯和乙炔
C.1、3—戊二烯和2—丁炔
D.2、3—二甲基—丁二烯和2—丁炔
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省哈尔滨市高一下学期第一次月考化学试卷(解析版) 题型:实验题
(6分)下图为实验室制取氨的实验装置。

(1)写出A中所发生反应的化学方程式______________________________________________。
(2)该装置还可以制备哪种气体________。
(3)在收集氨时试管口棉花团的作用是 。
(4)收集氨气应使用__________法,要得到干燥的氨气可选用__________作干燥剂.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com