
| A. | 难溶电解质的Ksp越小,溶解度就一定越小 | |
| B. | 向含AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小 | |
| C. | 用饱和Na2CO3溶液可以将BaSO4转化为BaCO3,说明Ksp(BaCO3)小于Ksp(BaSO4) | |
| D. | 一般认为沉淀离子浓度小于1.0×10-5 mol/L时,离子就已沉淀完全 |
分析 A.Ksp越小,电解质的溶解度不一定越小,溶度积常数与温度有关系,与溶液类型以及浓度无关;
B.溶度积常数与温度有关系,与溶液类型以及浓度无关;
C.若满足Qc>Ksp,可生成沉淀;
D.沉淀不可能完全沉淀,当离子浓度小于1.0×10-5mol/L时,可认为沉淀完全.
解答 解:A.Ksp越小,电解质的溶解度不一定越小,溶解度还取决于溶液的类型和浓度关系,以及物质的摩尔质量等因素,例如AgCl在水中和盐酸中的溶解度不同,但溶度积相同,故A错误;
B.溶度积常数与温度有关系,与溶液类型以及浓度无关,故B错误;
C.BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀,是因为碳酸根离子浓度大,和钡离子浓度乘积等于碳酸钡的Ksp,实际Ksp(BaSO4)小于Ksp(BaCO3),故C错误;
D.沉淀不可能沉淀完全,当离子浓度小于1.0×10-5mol/L时,可认为沉淀完全,故D正确;
故选D.
点评 本题考查了沉淀溶解平衡及其影响,题目难度不大,注意绝对不溶的物质是没有的,满足Qc>Ksp,可生成沉淀,明确溶解平衡及其影响为解答关键,试题培养了学生的灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 非金属性:Y<X<W | |
| B. | 简单气态氢化物的热稳定性:Y<X | |
| C. | 化合物ZW、XY中化学键类型相同 | |
| D. | X、W的最高价氧化物的水化物均为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol/L | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O${\;}_{8}^{2-}$)/mol/L | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
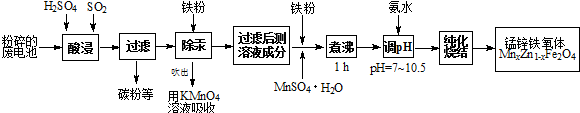
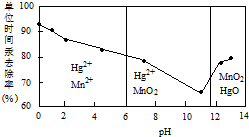
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
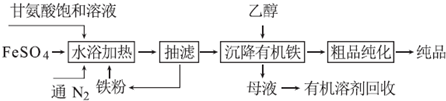
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 35 | 0.32 | 0.34 | 0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
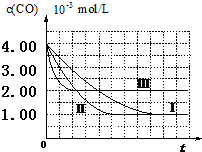 目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 6.50×10-3 | 120 | |||
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 问题 | 评价 |
| A | 用稀硝酸清洗做过银镜反应的试管 Ag+4H++NO3-=Ag++NO↑+2H2O | 错误,物质拆分错误 |
| B | 离子组 Na+、K+、HCO3-、OH- | 不能大量共存于同一溶液中,因为发生反应: HCO3-+OH-=H2O+CO2↑ |
| C | 反应: Cu2+(aq)+MnS(s)?CuS(s)+Mn2+(aq) | 该反应的平衡常数表达式:K=$\frac{{K}_{sp}(MnS)}{{K}_{sp}(CuS)}$ |
| D | 在硫酸氢钠溶于水的过程中 | 只有离子键被破坏没有共价键被破坏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H<0的反应均是自发反应 | |
| B. | 自发进行的反应一定能迅速进行 | |
| C. | 高锰酸钾加热分解是一个熵减小的过程 | |
| D. | 冰在室温下自动熔化成水,是熵增的重要结果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com