
下列对氨基酸和蛋白质的描述正确的是( )
A.蛋白质水解的最终产物是氨基酸
B.氨基酸和蛋白质遇重金属离子均会变性
C.α-氨基丙酸与α-氨基苯丙酸混合物脱水成肽,只生成2种二肽
D.氨基酸溶于水过量氢氧化钠溶液中生成离子,在电场作用下向负极移动
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:2015-2016学年辽宁庄河高中高一下期中化学试卷(解析版) 题型:选择题
把A、B、C、D四块金属泡在稀H2SO4中,用导线两例相连可以组成各种原电池。若A、B相连时,A为负极;C、D相连,D上有气泡逸出;A、C相连时A极减轻;B、D相连,B为正极.则四种金属的活泼性顺序由大到小排列为( )
A.A>B>C>D B.A>C>D>B C.A>C>B>D D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(江苏卷参考版) 题型:填空题
[物质结构与性质]
[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN

(1)Zn2+基态核外电子排布式为____________________。
(2)1 mol HCHO分子中含有σ键的数目为____________mol。
(3)HOCH2CN分子中碳原子轨道的杂化类型是______________。
(4)与H2O分子互为等电子体的阴离子为________________。
(5)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为_____________。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(江苏卷参考版) 题型:选择题
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族。下列说法正确的是
A.元素X、W的简单阴离子具有相同的电子层结构
B.由Y、Z两种元素组成的化合物是离子化合物
C.W的简单气态氢化物的热稳定性比Y的强
D.原子半径:r(X)<r(Y)<r(Z)<r(W)
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(天津卷参考版) 题型:简答题
下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(谢元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式__________。
(5)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为__________。Q与水反应的化学方程式为__________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种气体组成,气体的相对分子质量都小于50.为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol/LNaOH溶液和1molO2,则两种气体的分子式及物质的量分别为__________,生成硫酸铜物质的量为__________。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(四川卷参考版) 题型:填空题
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是① ,X和Y中电负性较大的是 ② (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中黑球代表的离子是_________(填离子符号)。
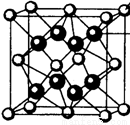
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(四川卷参考版) 题型:选择题
化学与生产和生活密切相关。下列过程中没有发生化学变化的是
A.氯气作水杀菌消毒剂
B.硅胶作袋装食品的干燥剂
C.二氧化硫作纸浆的漂白剂
D.肥皂水作蚊虫叮咬处的清洗剂
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(全国2卷参考版) 题型:实验题
某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁属,其目的是________。
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二只试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_____(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为______。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl3溶液,溶液·变成棕黄色,发生反应的离子方程式为________;一段时间后.溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是______;生成沉淀的原因是______(用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:选择题
下列实验方案中,不能达到实验目的是( )
选项 | 实验目的 | 实验方案 |
A | 实验室制乙炔 | 用电石和饱和食盐水反应,将产生的气体再通入到硫酸铜溶液中除杂 |
B | 检验溴乙烷在氢氧化钠溶液中是否发生水解 | 将溴乙烷和氢氧化钠溶液共热.冷却后,取上层清液,用稀硝酸酸化,再加硝酸银溶液,观察是否产生淡黄色沉淀 |
C | 除去乙烷中的乙烯气体 | 将混合气体通入到装有高锰酸钾溶液的洗气瓶中 |
D[ | 验证氢氧化铁的溶解度小于氢氧化镁 | 将氯化铁溶液加入到氢氧化镁悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com