
| A. | 由水电离出的c (OH-)=10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、Br- | |
| B. | c(H+)/c(OH-)=1012的溶液中:Fe2+、Al3+、NO3-、Cl- | |
| C. | 含大量Al3+的溶液中:K+、Na+、SO42-、ClO- | |
| D. | 无色溶液中:K+、Na+、MnO4-、SO42- |
分析 A.由水电离出的c (OH-)=10-13mol•L-1的溶液中存在大量氢离子或氢氧根离子,
B.该溶液呈酸性,溶液中存在大量氢离子,酸性条件下硝酸根离子能够氧化亚铁离子;
C.铝离子与偏铝酸根离子发生双水解反应;
D.高锰酸根离子为有色离子.
解答 解:A.由水电离出的c (OH-)=10-13mol•L-1的溶液呈酸性或强碱性,溶液中存在大量氢离子或氢氧根离子,Na+、Ba2+、Cl-、Br-之间不反应,都不与氢离子、氢氧根离子反应,在溶液中能够大量共存,故A正确;
B.c(H+)/c(OH-)=1012的溶液呈酸性,Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.Al3+、ClO-之间发生双水解反应,在溶液中不能大量共存,故C错误;
D.MnO4-为有色离子,在溶液中不能大量存在,故D错误;
故选A.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 如果设“此”为电解质,“彼”为非电解质,不是所有的物质都是非此即彼的 | |
| B. | 不是所有反应,都遵循由强(如强酸、强碱、强氧化剂或强还原剂等)制弱(如弱酸、弱碱、弱氧化剂 或弱还原剂等)的规律 | |
| C. | 不是所有自发进行的反应都一定是焓减少的过程 | |
| D. | 在迄今发现的元素中,不一定所有非金属元素(稀有气体除外)都满足条件“主族元素的族序数≥其周期序数” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的蔗糖溶液 | B. | 0.1mol/L的CaCl2溶液 | ||
| C. | 0.2mol/L的NaCl溶液 | D. | 0.1mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  操作I导致配制溶液的物质的量浓度偏小 | |
| B. |  用装置II干燥氨气 | |
| C. |  实验Ⅲ可观察铁钉的吸氧腐蚀 | |
| D. |  实验Ⅳ记录的读数为12.20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑦ | B. | ⑥ | C. | ⑥⑦ | D. | ⑤⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

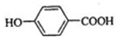 ;
; ,该反应类型为取代反应;
,该反应类型为取代反应; (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应进行60s时,X、Y、Z的浓度相等 | |
| B. | 反应进行80s时,逆反应速率大于正反应速率 | |
| C. | 以X浓度变化表示的反应速率为0.06mol/(L•min) | |
| D. | 反应进行80s时,Y物质的量浓度为0.03mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2只作氧化剂 | |
| B. | 2 mol FeSO4发生反应时,反应中共有8 mol电子转移 | |
| C. | 每生成16g氧气就有1mol Fe2+ 被还原 | |
| D. | Na2FeO4既是还原产物又是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl是电解质,所以NH4C1在溶液通电时可以电离 | |
| B. | A1(OH)3是两性氢氧化物,所以不能用过量的氨水与铝盐制备 | |
| C. | 用FeCl3溶液制作印刷电路板的原因是Fe3+具有氧化性 | |
| D. | Fe(OH)3胶体的本质特征是能产生丁达尔效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com