
常温时,将V1 mL c1 mol·L-1的氨水滴加到V2 mL c2 mol·L-1的盐酸中,下述结论中正确的是( )
A.若混合溶液的pH=7,则c1V1>c2V2
B.若V1=V2,c1=c2,则混合液中c(N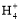 )=c(Cl-)
)=c(Cl-)
C.若混合液的pH=7,则混合液中c(N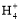 )>c(Cl-)
)>c(Cl-)
D.若V1=V2,且混合液的pH<7,则一定有c1<c2
科目:高中化学 来源:2014高考化学名师选择题专练 NA的应用练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
B.在熔融状态下,1 mol NaHSO4完全电离出的阳离子数为2NA
C.78 g Na2O2固体与H2O完全反应转移的电子数为NA
D.5.6 g铁粉在2.24 L(标准状况)氯气中充分燃烧,失去的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修3物质结构与性质练习卷(解析版) 题型:填空题
Ⅰ.金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子的价电子(外围电子)排布式为 。
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 。
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2 CH2、②HC≡CH、③
CH2、②HC≡CH、③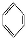 、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。
、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。
(4)Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO FeO(填“<”或“>”)。
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 。
(6)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如右下图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。
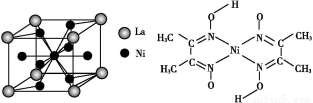
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修2化学与技术练习卷(解析版) 题型:选择题
金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法不正确的是( )
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Al都是用电解熔融氯化物制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题9溶液中的电离平衡练习卷(解析版) 题型:填空题
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)常温下,在pH=5的稀醋酸溶液中,c(CH3COO-)= (列式,不必化简);下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是 。
a.加入少量0.10 mol·L-1的稀盐酸
b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸) V(醋酸),反应的最初速率为:v(盐酸) v(醋酸)(填“>”、“<”或“=”)。
(3)常温下,向体积为Va mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是 。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为 。
(5)已知:90 ℃时,水的离子积常数为KW=3.8×10-13,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)= (保留三位有效数字) mol/L。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题9溶液中的电离平衡练习卷(解析版) 题型:选择题
已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2 HCN+NaNO2,NaCN+HF
HCN+NaNO2,NaCN+HF HCN+NaF,NaNO2+HF
HCN+NaF,NaNO2+HF HNO2+NaF
HNO2+NaF
由此可判断下列叙述不正确的是( )
A.K(HF)=7.2×10-4
B.K(HNO2)=4.9×10-10
C.根据其中两个反应即可得出结论
D.K(HCN)<K(HNO2)<K(HF)
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题8化学反应速率与化学平衡练习卷(解析版) 题型:选择题
在容积一定的密闭容器中发生可逆反应A(g)+2B(g) 2C(g) ΔH>0;平衡移动关系如图所示。下列说法正确的是( )
2C(g) ΔH>0;平衡移动关系如图所示。下列说法正确的是( )
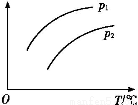
A.p1<p2,纵坐标指A的质量分数
B.p1>p2,纵坐标指C的质量分数
C.p1<p2,纵坐标指A的转化率
D.p1<p2,纵坐标指混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题7元素周期表与元素周期律练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题3离子反应练习卷(解析版) 题型:选择题
下列离子方程式正确的是( )
A.向40 mL 8 mol/L的硝酸溶液中加入5.6 g铁粉:Fe+4H++NO3— Fe3++NO↑+2H2O
Fe3++NO↑+2H2O
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO- CaSO3↓+2HClO
CaSO3↓+2HClO
C.漂白粉溶液在空气中失效:ClO-+CO2+H2O HClO+HCO3—
HClO+HCO3—
D.Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO42— BaSO4↓+2H2O
BaSO4↓+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com