
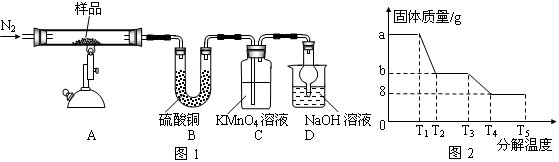
 Fe2O3+SO2↑+SO3↑ (5)防止氢氧化钠溶液倒吸 (6)x= 7
Fe2O3+SO2↑+SO3↑ (5)防止氢氧化钠溶液倒吸 (6)x= 7 Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。

科目:高中化学 来源:不详 题型:单选题
| A.过滤 | B.蒸发 | C.蒸馏 | D.萃取 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向某溶液中加入Na2CO3溶液,若有白色沉淀生成,证明一定含有Ca2+ |
| B.向某固体中加入稀盐酸,产生了无色气体,证明该固体一定含有CO32— |
| C.向某溶液中滴加KSCN溶液,若溶液出现红色则说明原溶液中含Fe3+ |
| D.向某溶液中先加稀硝酸,再加BaC12溶液,生成白色沉淀,证明一定含有SO42— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
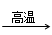 4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
 4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
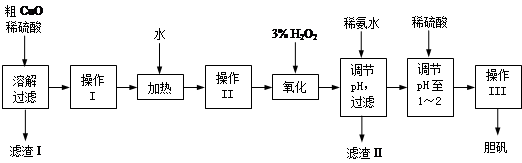
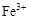 、
、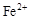 、
、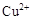 转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:| | 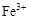 | 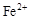 | 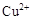 |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
| | 第一次实验 | 第二次实验 |
| 坩埚质量(g) | 14.520 | 14.670 |
坩埚质量 晶体质量(g) 晶体质量(g) | 17.020 | 18.350 |
| 第一次加热、冷却、称量(g) | 16.070 | 16.989 |
| 第二次加热、冷却、称量(g) | 16.070 | 16.988 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.① | B.①②④ | C.①②③ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2NaVO3 +2NaAlO2 +2CO2
2NaVO3 +2NaAlO2 +2CO2
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用HF溶液可以除去硅晶体中含有的少量二氧化硅晶体 |
| B.向两份Fe3O4固体中分别加入HCl溶液与HI溶液,二者反应现象一样 |
| C.向某溶液中滴加NaOH溶液后又加入酚酞,溶液呈红色,说明原溶液中含有NH4+ |
| D.向某溶液中加入足量的稀HNO3溶液,所得气体能使澄清石灰水变浑浊,证明该溶液中存在CO32-或HCO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氨水 | B.AgNO3 | C.NaOH | D.BaCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com