
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
分析 (1)①依据平衡常数随温度变化分析,温度越高平衡常数越小,说明平衡逆向进行;
②依据浓度商和平衡常数比较分析判断反应进行的方向;
(2)原电池中负极上燃料失电子,碱性条件下,CH3OH反应生成碳酸根离子;根据电极反应判断氢氧根离子浓度的变化.
解答 解:(1)①由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,故答案为:<;
②、将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时的浓度商Qc=$\frac{2}{2×{3}^{2}}$=$\frac{1}{9}$,小于0.27,故反应向正反应进行,故选:A;
(2)原电池放电时,甲醇失电子被氧化,应为电池负极反应,其电极反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O;已知电池总反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,正极电极反应式为:O2+2H2O+4e-=4OH-,电池在放电过程中消耗氢氧根离子,所以溶液的pH减小;
故答案为:O2+2H2O+4e-=4OH-;减小.
点评 本题综合性较大,涉及化学平衡常数、反应的热效应、原电池与电解池工作原理及计算等,难度中等,注意原电池书写.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年湖南省高二上第三次月考化学卷(解析版) 题型:选择题
下列有关卤族元素及其化合物的表示正确的是( )
A. 氟离子的结构示意图: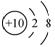 B. 次氯酸的结构式:H-Cl-O
B. 次氯酸的结构式:H-Cl-O
C. 溴化铵的电子式: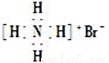 D. 质子数为53,中子数为78的碘原子:
D. 质子数为53,中子数为78的碘原子: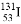
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
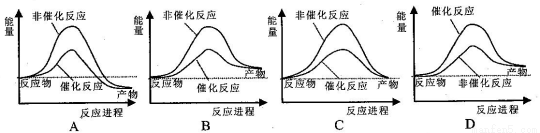
合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g) CO2(g)+4H2(g)已知,破坏1mol化学键需要吸收的热量如下表所示:
CO2(g)+4H2(g)已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
试通过计算判断,下列有关甲烷转化成氢气过程的能量变化示意图正确的是
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Al(OH)3+3H+,生成的胶体能吸附水中的悬浮物,从而达到净水目的.
Al(OH)3+3H+,生成的胶体能吸附水中的悬浮物,从而达到净水目的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碳酸氢钠制碳酸钠 | B. | 用铁矿石冶炼金属铁 | ||
| C. | 用氯气和消石灰制漂白粉 | D. | 用氨气制取一氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在饱和氯水中通入H2S气体,溶液的pH变小 | |
| B. | 在饱和氯水中通入SO2气体,溶液的pH变小 | |
| C. | 在饱和氯水中加入CaCO3,平衡向右移,溶液的pH变大 | |
| D. | 在饱和氯水中加入NaOH使pH=7,所得溶液中微粒浓度:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 3 | C. | 2 | D. | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com